In BE MOBILE 1 eingeschlossen wurden 254 Patienten mit aktiver nr-axSpA (BASDAI und Rückenschmerz-Score ≥4, Sakroiliitis im MRT und/oder erhöhtes CRP). Die Teilnehmer (im Mittel 39,4 Jahre, Krankheitsdauer 9,0 Jahre, 54,3 % Männer, 77,6 % HLA-B27 positiv, 10,6 % mit TNFα-Inhibitor vorbehandelt) wurden in der doppelblinden Phase für 16 Wochen im Verhältnis 1:1 auf Bimekizumab 160 mg alle 4 Wochen (Q4W) oder Placebo randomisiert, in einer 36-wöchigen Erhaltungsphase erhielten alle Patienten Bimekizumab (96,1 % schlossen Woche 16 und 94,5 % Woche 24 ab).
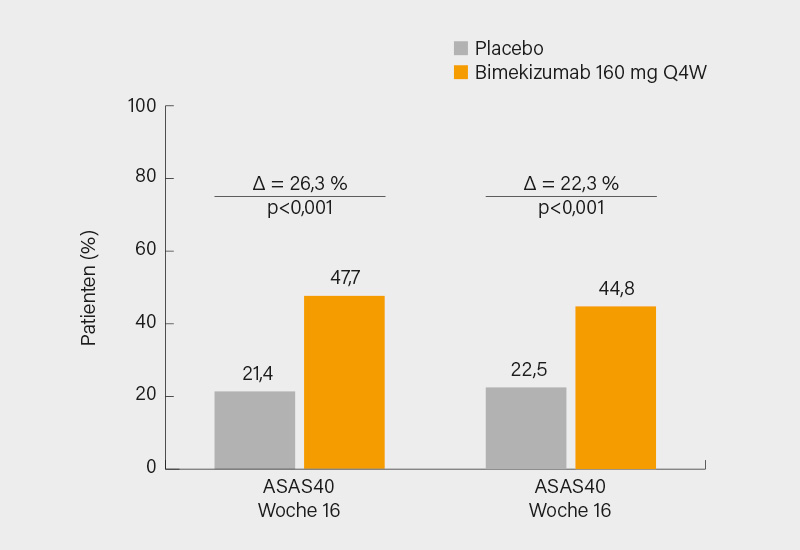
Den primärer Endpunkt, das ASAS40-Ansprechen in Woche 16, erreicht signifikant mehr der mit Bimekizumab behandelten Patienten (47,7 vs. 21,4 %; p<0,001, Abb. li.). Auch alle hierarchischen sekundären Endpunkte (ΔBASDAI, ASAS20, ASAS PR, ASAS MI, ASAS 5/6, ΔBASFI, nächtlicher Rückenschmerz, ΔASQoL und ΔSF-36 PCS) wurden in Woche 16 signifikant erreicht (je p<0,001). Bis Woche 2 bzw. 16 stellte sich eine substanzielle Reduktion des hsCRP und der Sakroiliitis im MRT ein. Bis Woche 24 zeigte sich eine weitere Steigerung des Ansprechens auf Bimekizumab (ASAS40 52,3 %), die erst in Woche 16 umgestellten Patienten holten rasch auf (ASAS40 46,8 %).
Das Studiendesign der komplementären BE MOBILE 2-Studie ist recht ähnlich (16-wöchige doppelblinde, 36-wöchige Erhaltungsphase), eingeschlossen wurden hier 332 Patienten mit aktiver r-axSpA (die modifizierten New York-Kriterien erfüllend, BASDAI und Rückenschmerz-Score ≥4). Die Teilnehmer (im Mittel 40,4 Jahre, Krankheitsdauer 13,5 Jahre, 72,3 % Männer, 85,5 % HLA-B27 positiv, 16,3 % mit Anti-TNF-Vorbehandlung) wurden diesmal im Verhältnis 2:1 für 16 Wochen auf Bimekizumab 160 mg Q4W oder Placebo randomisiert, danach erhielten für 36 Wochen alle Patienten Bimekizumab (97,0 % schlossen Woche 16 und 94,3 % Woche 24 ab).
Den primären Endpunkt, auch in dieser Studie das ASAS40-Ansprechen in Woche 16, erreichten mit 44,8 vs. 22,5 % (p<0,001) (Abb. re.)signifikant mehr Patienten unter Bimekizumab, auch sämtliche hierarchischen sekundären Endpunkte (der ASAS40 bei TNF-naiven Patienten, ASAS20, ΔBASDAI, ASAS PR und andere wie in BE MOBILE 1) wurden signifikant erfüllt (p<0,001). Auch in puncto Entzündung (SPARCC MRT-Score, hsCRP) zeigten sich signifikant positive Effekte.
Es bestand keine relevante Differenz im ASAS40 zwischen TNF-naiven und vorbehandelten Patienten (45,7 vs. 23,4 % bzw. 40,5 vs. 17,6 %). Das ASAS40-Ansprechen stieg bis Woche 24 auf 53,8 % an, die erst in Woche 16 auf Bimekizumab umgestellten Patienten holten rasch auf (56,8 %).
Fazit: Gutes Nutzen-Risiko-Profil
Im gesamten Spektrum, einschließlich TNF-vorbehandelter axSpA-Patienten, zeigte der IL-17A/F-Inhibitor somit eine gute Wirksamkeit, die Zulassung dürfte reine Formsache sein. Denn auch das Sicherheitsprofil ist durchaus positiv: Die häufigsten therapieassoziierten unerwünschten Ereignisse unter Bimekizumab (>3 %) waren Nasopharyngitis, Infektionen der oberen Atemwege, Pharyngitis, Diarrhö, Kopfschmerzen und orale Candidiasis. Es traten unter Bimekizumab gegenüber Placebo mehr Pilzinfektionen (alle lokalisiert) auf, es kam aber nicht zu schweren kardiovaskulären Ereignissen (MACE) oder aktiver Tuberkulose. Die Inzidenz von Uveitis und chronisch-entzündlichen Darmerkrankungen (CED) war gering.
Quelle: Ann Rheum Dis 2023; doi: 10.1136/ard-2022-223595