Strukturell ist Voclosporin mit Azathioprin verwandt, weist jedoch durch die Eingliederung eines C-Atoms mit Doppelbindung eine gegenüber diesem 4-fach höhere Potenz auf. In die AURORA-1-Studie wurden in 27 Ländern 357 erwachsene Patienten (88 % Frauen, mittleres Alter 31 Jahre) mit aktiver LN gemäß den ACR-Kriterien eingeschlossen und im Verhältnis 1:1 für 52 Wochen auf Voclosporin 2x 23,7 mg/Tag oder Placebo (jeweils plus Therapie mit MMF 2 g/Tag plus Steroiden) randomisiert. Die Einschlusskriterien waren eine bioptisch gesicherte LN (Klasse III, IV, V) sowie eine Proteinurie von >1,5 mg/mg oder >2 mg/mg für Klasse V-Patienten. Primärer Endpunkt war ein vollständiges renales Ansprechen (CRR) in Woche 52, definiert als Komposit aus einem Albumin-Kreatinin-Verhältnis im Urin (uPCR) von ≤0,5 mg/mg, einer eGFR ≥60 ml/min. oder keiner bestätigten eGFR-Abnahme >20 % ab Baseline, eine stabile Einnahme niedrig-dosierter Steroide (≤10 mg Prednison/Tag von Woche 44 bis 52) und keine Gabe einer Rescue-Medikation. Gefordert war zudem eine rasche Steroidreduktion von 20-25 mg/Tag in Woche 1 auf 2,5 mg/Tag in Woche 16.
Signifikant besseres renales Ansprechen nachgewiesen
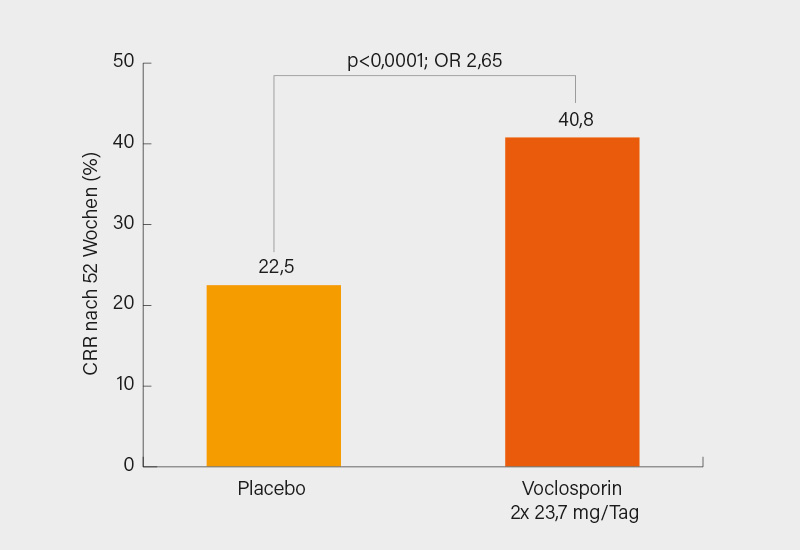
Den primären Endpunkt einer CRR in Woche 52 erreichten in der Intention-to-treat-Analyse 40,8 % der Patienten unter der Zusatztherapie mit Voclosporin gegenüber 22,5 % in der Placebogruppe (Odds ratio, OR 2,65; p<0,0001) (Abb.). Signifikant häufiger erreichten mit Voclosporin behandelte Patienten auch die hierarchischen sekundären Endpunkte wie ein CRR in Woche 24 (32,4 vs. 19,7 %, OR 2,23; p=0,002), ein partielles renales Ansprechen (PRR) in Woche 24 (70,4 vs. 50,0 %, OR 2,43; p<0,001) und Woche 52 (69,8 vs. 51,7 %; OR 2,26; p<0,001), die Zeit bis zum Erreichen eines uPCR ≤0,5 mg/mg (Hazard ratio, HR 2,02; p<0,001) und die Zeit bis zur Reduktion des uPCR um 50 % (HR 2,05; p<0,001). Der Wirksamkeitsvorteil von Voclosporin im CRR erstreckte sich auch über prä-spezifizierte Biopsie-Subgruppen, so für die reine Klasse V LN (OR 2,74) und Klasse III/IV allein oder in Kombination mit Klasse V-Patienten (OR 2,63). Selbiges galt auch für alle präspezifizierten Subgruppenanalysen (z. B. Alter, Geschlecht, Ethnizität, vorherige MMF-Einnahme).
Auch das Sicherheitsprofil war insgesamt positiv: Die Inzidenz schwerer unerwünschter Ereignisse war mit 20,8 vs. 21,3 % vergleichbar, am häufigsten waren Infektionen (10,1 vs. 11,2 %), insbesondere Pneumonien, die aber in beiden Therapiearmen gleich verteilt waren. Die Sterblichkeit war gering mit nur einem Fall unter Voclosporin (<1 %) und fünf Fällen im Placeboarm (3 %), in keinem Fall war eine Assoziation mit der Studienmedikation gegeben. Dies war von besonderem Interesse, da in der Phase-II-Studie noch eine erhöhte Sterblichkeit unter Voclosporin gesehen wurde. Unter Voclosporin kam es zu keiner signifikanten Abnahme der eGFR oder einem Anstieg von Blutdruck, Lipiden oder des Glukosespiegels bis Woche 52.
Die Zusatztherapie mit dem neuartigen CNI Voclosporin bot im Hinblick auf ein vollständiges renales Ansprechen somit eine überlegene Wirksamkeit gegenüber der alleinigen Standardtherapie mit MMF bei Patienten mit aktiver LN. Der Weg zur Zulassung auch in Europa scheint damit gebahnt, in den USA ist diese bereits erfolgt.
Quelle: Lancet 2021; 397(10289): 2070-2080