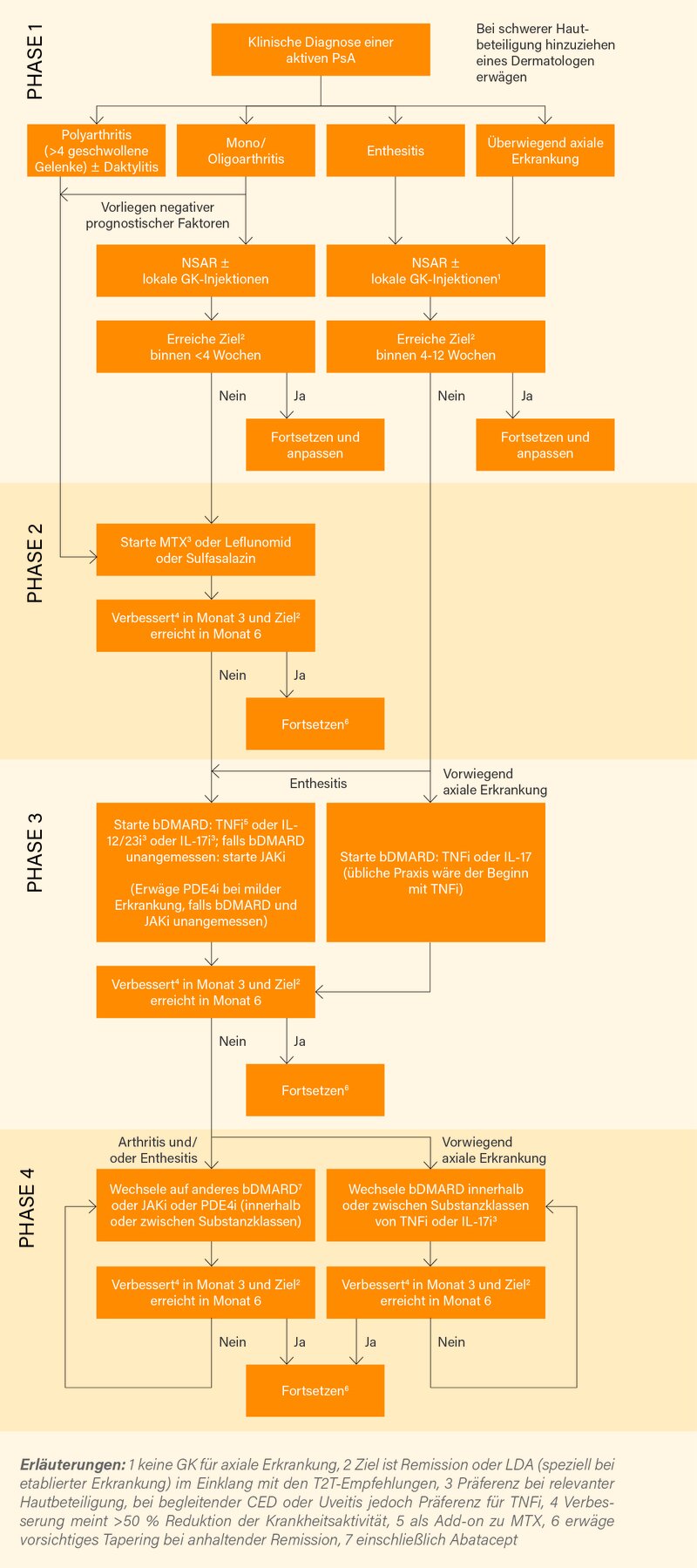
Nach einem Abstimmungsverfahren gemäß den üblichen EULAR SOPs auf Basis eines systematischen Literaturreviews einigte sich die 28-köpfige internationale Task Force im Mai 2019 auf 6 (zuvor 5) übergreifende Prinzipien und 12 (zuvor 10) spezifische Empfehlungen zur PsA-Therapie aus rheumatologischer Sicht.
Übergreifende Prinzipien
Die ersten vier übergreifenden Prinzipien blieben unverändert, eines wurde umformuliert und eines neu festgelegt. Weiter wird betont, dass es sich bei der PsA um eine heterogene und potenziell schwere Erkrankung handelt, die eine multidisziplinäre Behandlung erforderlich machen kann (A).
Anzustreben bei der PsA-Therapie ist eine bestmögliche Versorgung, sie sollte in Bezug auf Effektivität, Sicherheit und Kosten auf einer gemeinsamen Entscheidung („shared decision“) von Patient und Rheumatologen basieren (B.) Rheumatologen sind die Spezialisten, die primär für die Versorgung muskuloskelettaler Manifestationen von PsA-Patienten zuständig sind; bei klinisch relevanter Hautbeteiligung sollte in puncto Diagnose und Therapie mit einem Dermatologen zusammengearbeitet werden (C).
Primäres Ziel der Therapie von PsA-Patienten ist die Maximierung der gesundheitsbezogenen Lebensqualität durch Symptomkontrolle, Prävention struktureller Schäden, Normalisierung der Funktion und sozialen Teilhabe; die Aufhebung der Entzündung ist eine wichtige Komponente für das Erreichen dieser Ziele (D).
Neu ist: Beim Management von PsA-Patienten sollte jede muskuloskelettale Manifestation berücksichtigt und in die Therapieentscheidung einbezogen werden (E). Leicht umformuliert wurde das letzte Prinzip: Beim Management von Patienten mit PsA sollten nicht-muskuloskelettale Manifestationen (Haut, Auge, Gastrointestinal-Trakt) ins Kalkül gezogen werden, Komorbiditäten wie metabolisches Syndrom, kardiovaskuläre Erkrankungen oder Depression sollten ebenfalls berücksichtigt werden (F).
Spezifische Empfehlungen
Die Behandlung sollte am Ziel einer Remission oder alternativ niedrigen Krankheitsaktivität ausgerichtet werden mittels einer regelmäßigen Erfassung der Krankheitsaktivität und einer entsprechenden Anpassung der Therapie. Diese Empfehlung (1) wurde im Einklang mit den aktualisierten Treat-to-target (T2T)-Empfehlungen zur PsA leicht umformuliert (minimale Krankheitsaktivität wurde gestrichen). NSAR können zur Linderung muskuloskelettaler Zeichen und Symptome eingesetzt werden, diese Empfehlung (2) wurde nur minimal umformuliert. Neu sortiert, ansonsten aber unverändert blieb Empfehlung (3): Lokale Glukokortikoid (GK)-Injektionen sollten als Zusatztherapie bei PsA erwogen werden; systemische GK können mit Vorsicht in der niedrigsten effektiven Dosis eingesetzt werden.
Deutlich modifiziert bzw. neu sind folgende Empfehlungen: Bei Patienten mit Polyarthritis sollte rasch ein csDMARD initiiert werden, präferenziell Methotrexat (MTX) bei relevanter Hautbeteiligung (4). Bei Mono- oder Oligoarthritis, insbesondere bei Vorliegen negativer prognostischer Faktoren wie strukturellen Schäden, hohen Akute-Phase-Reaktanten (ESR/CRP), Daktylitis oder Nagelbeteiligung, sollte ein csDMARD erwogen werden (5). Neu ist damit (zuvor wurde ganz allgemein auf periphere Arthritis abgehoben) die Differenzierung zwischen Poly- und Mono- bzw. Oligoarthritis und die Betonung auf eine rasche und adäquate Therapie auch der Monoarthritis, unverändert blieb hingegen die Festlegung auf csDMARDs (primär MTX) als First-line-Therapie, letzteres auf Basis der TICOPA- und vor allem der SEAM-PsA-Studie, wobei aber auch Kostenaspekte klar eine Rolle spielten (daher auch der klare Unterschied zur ACR-Leitlinie 2018, in der TNFα-Inhibitoren als Primärtherapie aufgeführt werden).
Modifiziert wurde Empfehlung (6): Bei Patienten mit peripherer Arthritis und unzureichendem Ansprechen auf ≥1 csDMARD sollte ein bDMARD begonnen werden; bei einer relevanten Hautbeteiligung kann ein IL-17- oder IL-12/23-Inhibitor präferiert werden. Zu beachten ist hier, dass IL-17/IL-12/23 (und künftig auch IL-23) bDMARDs den TNFα-Inhibitoren völlig gleichgestellt werden, auf Basis von Head-to-head-Studien aus der Plaque-Psoriasis und PsA (SPIRIT-H2H und jetzt auch EXCEED) gibt es eine recht klare Präferenz für IL-17/IL-12/23- gegenüber TNFα-Inhibitoren bei relevanter Hautmanifestation.
Neu ist Empfehlung (7): Bei Patienten mit peripherer Arthritis und unzureichendem Ansprechen auf ≥1 csDMARD und ≥1 bDMARD, oder wenn ein bDMARD unangemessen erscheint, kann ein JAK-Inhibitor (sprich Tofacitinib) erwogen werden. Nach positiven Phase-II bzw. III-Daten auch für Filgotinib und Upadacitinib wird dieses orale Therapieprinzip auch bei PsA weiter an Bedeutung gewinnen, die Ergebnisse dieser Studien stützen zusätzlich diese neue Empfehlung. Dass es keine Gleichstellung mit bDMARDs gibt, liegt an der bis dato etwas schwächeren Evidenz für ein ebenso gutes Hautansprechen.
Modifiziert wurde Empfehlung (8): Bei Patienten mit milder PsA (definiert als ≤4 Gelenke, niedrigere Krankheitsaktivität und/oder limitierter Hautbefall) und unzureichendem auf ≥1 csDMARD, bei denen weder ein bDMARD noch JAK-Inhibitor angemessen ist, kann ein PDE4-Inhibitor (sprich Apremilast) erwogen werden.
Modifiziert wurde gleichfalls Empfehlung (9): Bei Patienten mit eindeutiger Enthesitis und unzureichendem Ansprechen auf NSAR oder lokale GK-Injektionen sollte ein bDMARD erwogen werden (die vorherige Fokussierung auf TNFα-Inhibitoren wurde gestrichen). Ebenfalls modifiziert wurde Empfehlung (10): Bei PsA-Patienten mit vorwiegend axialer Erkrankung, die aktiv ist und unzureichend auf NSAR anspricht, sollte ein bDMARD erwogen werden, dies wäre nach gegenwärtiger Praxis (weiterhin) ein TNFα-Inhibitor; im Falle einer relevanten Hautbeteiligung kann ein IL-17-Inhibitor präferiert werden. Neuere Daten aus der MAXIMISE-Studien zu Secukinumab bei axialer PsA (und beiden IL-17-Inhibitoren bei axialer SpA generell) wurden diskutiert, zunächst bleibt es hier aber beim Vorrang der Anti-TNF-Therapien Auch modifiziert wurde Empfehlung (11): Bei Patienten, die nicht ausreichend auf ein bDMARD ansprechen, oder dieses nicht vertragen, sollte der Wechsel auf ein anderes bDMARD oder tsDMARD erwogen werden, auch ein Switch innerhalb der Substanzklasse ist möglich (aber nicht die primäre Option). Erst nach Versagen anderer bDMARDs wird (aufgrund der eher geringen Effektivität) auch ein Platz für Abatacept gesehen.
Gänzlich neu ist und vorwiegend auf Expertenmeinung beruht Empfehlung (12): Bei Patienten in anhaltender Remission kann ein vorsichtiges Tapering von DMARDs erwogen werden. Wie üblich wurde zur besseren Übersicht ein 4-stufiger Therapiealgorithmus entwickelt (Abb.).
Quelle: Ann Rheum Dis 2020; 79(6): 700-712