Die Overarching Principles zielen A) auf ein regelmäßiges Monitoring einer Nierenbeteiligung bei SLE-Patienten und dann eine zeitnahe Biopsie ab, weisen B) darauf hin, dass das Management mit den allgemeinen Empfehlungen zum SLE inklusive der Therapie mit Hydroxychloroquin (HCQ) im Einklang sein sollte, betonen C) das Risiko für eine progressive Nierenerkrankung und die Bedeutung eines gemeinsamen Managements durch Rheumatologen und Nephrologen als Team mit informierten Patienten einschließlich der regelmäßigen Erfassung von Risikofaktoren einer renalen Progression, sowie D) die Prävention einer renalen Progression/von Schüben und die Adressierung von Komorbiditäten und Lebensqualität, wobei jenseits von immunsuppressiven auch supportive Therapien, einschließlich Nierenschutz, essenziell sind.
Die Empfehlungen im Überblick
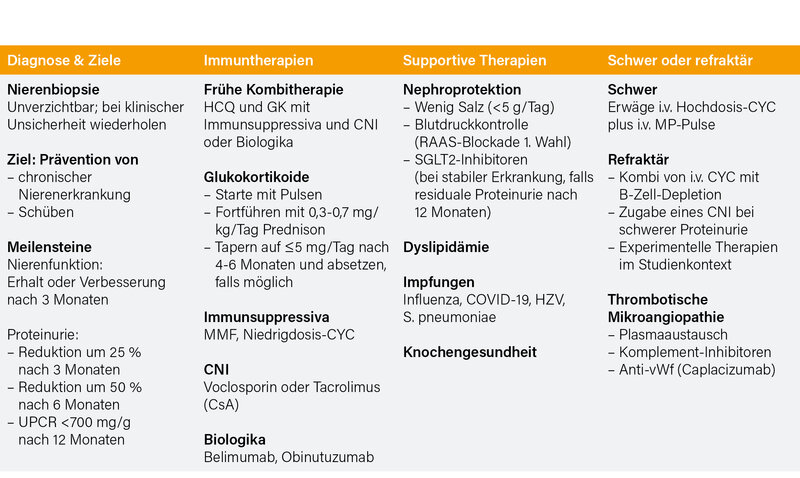
Eine Nierenbiopsie wird bei jedem Patienten mit Evidenz einer Nierenbeteiligung empfohlen, insbesondere bei jenen mit persistierender Proteinurie (≥0,5 g/24 h oder Urin-Protein-Kreatinin-Verhältnis [UPCR] ≥500 mg/g) und/oder glomerulärer Hämaturie und/oder unerklärter Abnahme der glomerulären Filtrationsrate (eGFR). (1) Die Therapie sollte eine Optimierung (Erhalt oder Verbesserung) der Nierenfunktion binnen drei Monaten anstreben, begleitet von einer Reduktion der Proteinurie um ≥25 % nach drei, 50 % nach sechs und einem UPCR-Zielwert <700 mg/g nach 12 Monaten, sowie danach so niedrig wie möglich. (2) In puncto Glukokortikoide (GK) werden initial Pulse empfohlen, danach die Fortsetzung mit Prednison 0,3-0,7 mg/kg/Tag und ein Tapering auf ≤5 mg/Tag nach 4-6 Monaten sowie, falls möglich, ein gänzliches Absetzen. (3)
Für Patienten mit aktiver LN, insbesondere solchen mit schlechten prognostischen Faktoren, wird eine Kombinationstherapie empfohlen, aus a) Mycophenolat (MMF) oder niedrig-dosiertem i.v. Cyclophosphamid (CYC) mit Belimumab, oder b) MMF und einem Calcineurin-Inhibitor (CNI; Voclosporin, Tacrolimus), oder c) MMF mit Obinutuzumab (dessen Zulassung bald ansteht und in der ACR-Leitlinie noch fehlt). Alternative Regime sind „Monotherapien“ mit entweder MMF oder niedrig-dosiertem CYC. (4) Letzteres steht im Gegensatz zur ACR-Leitlinie, ebenso wird anders als in dieser nicht (mehr) zwischen Klasse III/IV und V differenziert und neben MMF ist auch CYC ein Kombinationspartner. Auch spricht die EULAR (anders als der ACR) keine differenziellen Empfehlungen für Subgruppen für die Wahl zwischen Belimumab und CNI aus. Bei Patienten mit rapid-progressiver Glomerulonephritis kann ein kurzer Zyklus (6-7 monatliche Pulse) mit hoch-dosiertem i.v. CYC erwogen werden. (5) Nach einem renalen Ansprechen sollte die Therapie für ≥3 Jahre fortgesetzt werden, initial mit MMF allein oder in Kombination mit Belimumab oder CNI oder Obinutuzumab behandelte Patienten sollten darauf bleiben; Azathioprin oder MMF sollte CYC bei jenen ersetzen, die initial CYC allein oder in Kombination mit Belimumab erhielten. (6) Bei Patienten in anhaltender Remission kann unter Berücksichtigung des Flare-Risikos ein gradueller Entzug von Immunsuppressiva und/oder Biologika nach drei Jahren Therapie erwogen werden. (7) Für Patienten mit persistierend aktiver oder rezidivierender Erkrankung wird ein Switchen der vorgenannten Immunsuppressiva und/oder Biologika und die Überweisung zu Experten empfohlen. (8)
Eine wiederholte Nierenbiopsie sollte erwogen werden, insbesondere in klinisch unsicheren Fällen um das Therapieansprechen oder die Verschlechterung nierenspezifischer Laborwerte zu bewerten oder bei erwogenem Absetzen der immunsuppressiven Therapie. (9) Zusätzlich wird eine Therapie mit RAAS-Blockern (bei persistierender Proteinurie oder arterieller Hypertonie), SGLT-2-Inhibitoren (für stabile Patienten mit persistierender Proteinurie oder eGFR <60 ml/min/m2 oder anderen Risikofaktoren für eine progressive Nierenerkrankung), Statinen (basierend auf dem kardiovaskulären Risiko) und/oder knochenerhaltenden Substanzen empfohlen. Auch auf eine salzarme Diät und Vakzinierungen ist zu achten. (10) Bei Patienten mit Merkmalen einer thrombotischen Mikroangiopathie (Antiphospholipid-Syndrom-Nephropathie, thrombotisch-thrombozytopenische Purpura oder atypisches hämolytisch-urämisches Syndrom) sollten GK (i.v. Puls-Methylprednisolon), Komplement-Inhibitoren, B-Zell depletierende Substanzen, Caplacizumab, Plasmaaustausch und/oder eine Antikoagulation erwogen werden. (11) Bei Patientinnen mit inaktiver Nephritis und adäquat kontrollierten extra-renalen Manifestationen kann eine Schwangerschaft nach Beratung, der Initiierung damit kompatibler Medikationen mit regelmäßigen multidisziplinären Assessments geplant werden. (12) Alle Methoden einer Nierenersatztherapie können bei SLE-Patienten genutzt werden; bei solchen mit klinisch inaktiver extrarenaler Erkrankung für ≥6 Monate sollte eine Transplantation (einschließlich Lebendspende und präemptiver Transplantation) erwogen werden. (13) Ein Übersichtsdiagramm fasst die wichtigsten Punkte zusammen (Tab.).
Quelle: Ann Rheum Dis 2025; doi: 10.1016/j.ard.2025.09.007