Den auf einem systematischen Literaturreview basierenden neuen Empfehlungen werden weiter fünf übergreifende Prinzipen vorangestellt: (A) Die Behandlung der Patienten sollte auf eine bestmögliche Versorgung abzielen und muss auf einer „shared decision“ von Patient und Arzt basieren. (B) Die Therapieentscheidungen basieren auf der Krankheitsaktivität und Faktoren wie Progression struktureller Schäden, Komorbiditäten und Sicherheitsaspekten. (C) Für die Versorgung von Patienten mit RA sind Rheumatologen die primär zuständigen Spezialisten. Neu ist: (D) Patienten benötigen Zugang zu mehreren Medikamenten mit unterschiedlichen Wirkmechanismen (MoA), um die Heterogenität der RA zu adressieren; sie können mehrere erfolgreiche Therapien im Verlauf ihres ganzen Lebens benötigen. (E) Die RA verursacht hohe individuelle, medizinische und gesellschaftliche Kosten, die beim Management durch den behandelnden Rheumatologen berücksichtigt werden sollten.
Die Empfehlungen im Überblick
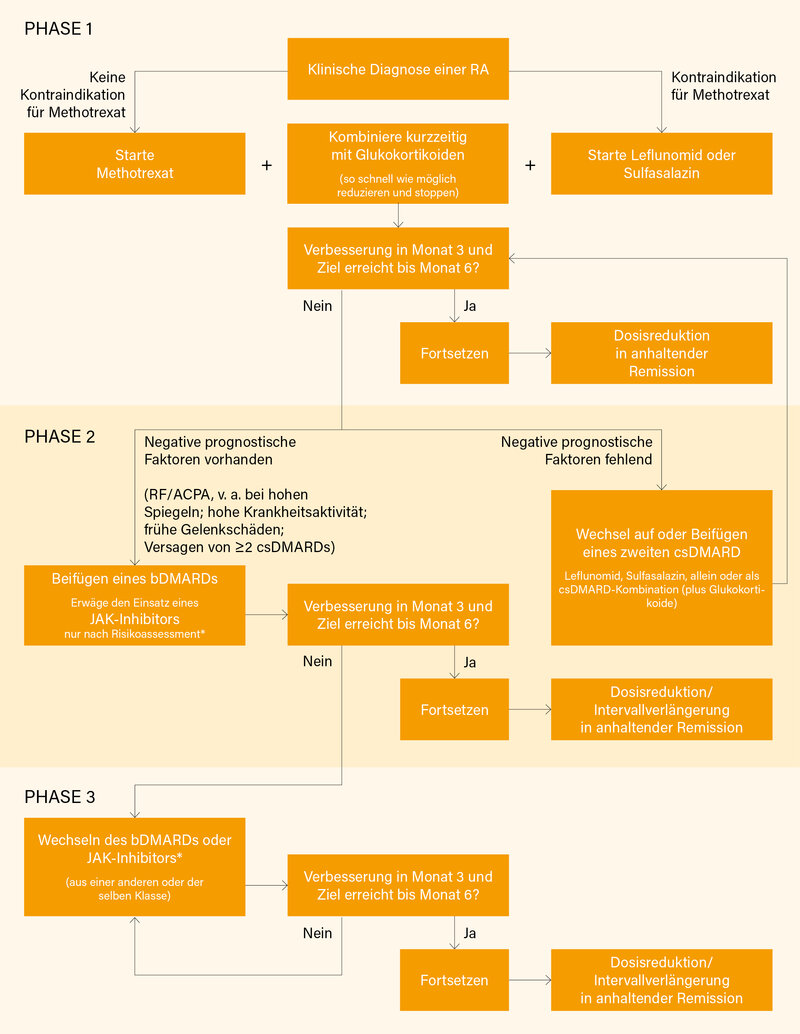
Im Vergleich zur EULAR-Leitlinie aus 2019 sind es nun 11 spezifische Empfehlungen zum Einsatz von csDMARDs, GK, bDMARDs und biosimilaren (bs)DMARDs sowie tsDMARDs. Unverändert blieben die ersten fünf Empfehlungen: (1) Eine csDMARD-Therapie soll initiiert werden, sobald eine RA diagnostiziert wurde. (2) Die Therapie soll auf das Erreichen des Ziels einer anhaltenden Remission oder niedrigen Krankheitsaktivität bei jedem Patienten abzielen. (3) Eine Verlaufskontrolle bei aktiver RA sollte regelmäßig (alle 1-3 Monate) erfolgen; stellt sich nach spätestens drei Monaten keine Besserung um ≥50 % ein oder wird das Therapieziel nach sechs Monaten verfehlt, sollte die Therapie angepasst werden. (4) MTX sollte Bestandteil der ersten Therapiestrategie sein. (5) Bei Kontraindikation oder früher Intoleranz gegen MTX sollten Leflunomid oder Sulfasalazin als Bestandteil der ersten Therapiestrategie erwogen werden. Die erste Änderung gab es bezüglich des Einsatzes von GK, der laut neuer ACR-Leitlinie möglichst ganz vermieden werden sollte, um langfristige Risiken zu verhüten. So weit ging die EULAR nicht. Es wird noch mehr Evidenz für den Start mit MTX plus GK gesehen (diese waren kurzfristig bDMARDs plus MTX fast gleichwertig), jedoch wird jetzt stärker die Notwendigkeit einer schnellen Dosisreduktion (und Beendigung!) von GK betont: (6) GK sollten kurzzeitig beim Start oder der Anpassung einer csDMARD-Therapie erwogen werden, in/auf verschiedenen Dosierungen bzw. Administrationswegen; ein Ausschleichen bzw. Stoppen sollte aber sobald klinisch möglich erfolgen.
Keine Änderung gab es bei Empfehlung (7): Wird das Therapieziel mit der ersten csDMARD-Strategie nicht erreicht, sollten bei Abwesenheit negativer prognostischer Faktoren andere csDMARDs erwogen werden. Bei der nächsten Empfehlung zum Vorgehen bei Vorliegen prognostisch ungünstiger Faktoren wurden eingehend die Konsequenzen aus der ORAL Surveillance-Studie zum (bei Risikopatienten) erhöhten Risiko für schwere kardiovaskuläre Ereignisse (MACE) und Malignitäten unter Tofacitinib abgewogen. In Patientenregistern wurde eine solche Risikosteigerung gegenüber bDMARDs bislang nicht gesehen. Ob es sich um einen Klasseneffekt handelt, bleibt offen, eine entsprechende Studie zu Baricitinib läuft noch. Klar scheint bei einem Blick auf eine ähnliche Sicherheitsstudie zu Tocilizumab, dass das potenziell erhöhte MACE-Risiko nicht über die Hemmung von Interleukin (IL)-6 vermittelt wird.
Entschieden hat man sich letztlich bei Empfehlung (8) für folgende Sicherheitsvariante: Wird das Therapieziel mit der ersten csDMARD-Strategie verfehlt und liegen negative prognostische Faktoren vor, sollte ein bDMARD beigefügt werden; JAK-Inhibitoren können erwogen werden, aber relevante Risikofaktoren (Alter >65 Jahre, früheres oder aktuelles Rauchen sowie andere Risikofaktoren für kardiovaskuläre Ereignisse, Malignitäten und thromboembolische Ereignisse) müssen berücksichtigt werden. Fast unverändert blieb Empfehlung (9): bDMARDs und tsDMARDs sollten mit einem csDMARD kombiniert werden; bei Patienten, bei denen eine Ko-Medikation mit csDMARDs nicht möglich ist, werden einige Vorteile für IL-6-Rezeptorinhbitoren(Ri) und tsDMARDs im Vergleich zu anderen bDMARDs gesehen. Leicht umgestellt wurde die Empfehlung (10), nachdem sich Hinweise fanden, dass nach Versagen eines IL-6Ri (analog zu TNFα-Inhibitoren) auch das selbe Wirkprinzip gute Ergebnisse liefern kann: Nach Versagen eines bDMARDs oder tsDMARDs sollte die Therapie mit einem anderen bDMARD oder tsDMARD erwogen werden; nach Versagen auf einen TNFα-Inhibitor/IL-6Ri können Patienten auf ein Medikament mit anderem Wirkmechanismus oder eine zweite Anti-TNF- oder Anti-IL-6-Therapie eingestellt werden. Zusammengefasst zu einer Empfehlung (11) wurden die vorherigen Empfehlungen 11 und 12: In Bezug auf eine Dosisreduktion von DMARDs wird jetzt klar betont, dass zuvor GK nicht nur reduziert, sondern abgesetzt sein sollten: Ist ein Patient nach Absetzen des GK in einer anhaltenden Remission, kann eine Dosisreduktion von bDMARDs, tsDMARDs und/oder csDMARDs erwogen werden. Wie üblich wurde ein Therapiealgorithmus (Abb.) entwickelt.
Quelle: Ann Rheum Dis 2022; doi: 10.1136/ard-2022-223356