In der Phase-II-Studie SLek wurden 341 erwachsene Patienten mit mäßigem bis schwerem aktiven SLE (fast durchweg Frauen, mittleres Alter 43 Jahre, Krankheitsdauer 10 Jahre, 70 % auf Kortikosteroiden, davon 25 % in Dosen ≥10 mg/Tag, 90 % auf Antimalariamitteln) im Verhältnis 1:1:1:1:1 für 48 Wochen auf 1x täglich (QD) ABBV-599 in hoher Dosis (HD; Elsubrutinib 60 mg plus Upadacitinib 30 mg), ABBV-599 in niedriger Dosis (LD; Elsubrutinib 60 mg plus Upadacitinib 15 mg), Elsubrutinib 60 mg, Upadacitinib 30 mg oder Placebo randomisiert. Nach einer Interimsanalyse (50 % der Patienten hatten Woche 24 erreicht) wurden der ABBV-599 LD- und Elsubrutinib-Arm aufgrund von Ineffektivität beendet. 205 Patienten setzten die Studie fort (ABBV-599 HD n=68, Upadacitinib 30 mg n=62 und Placebo n=75). Primärer Endpunkt war der Anteil von Patienten, die in Woche 24 ein SRI-4-Ansprechen und zugleich eine Steroiddosis ≤10 mg/Tag erreichten. Die Effektivität und Sicherheit wurden bis Woche 48 weiterverfolgt.
Signifikante Reduktion von Krankheitsaktivität und Schüben
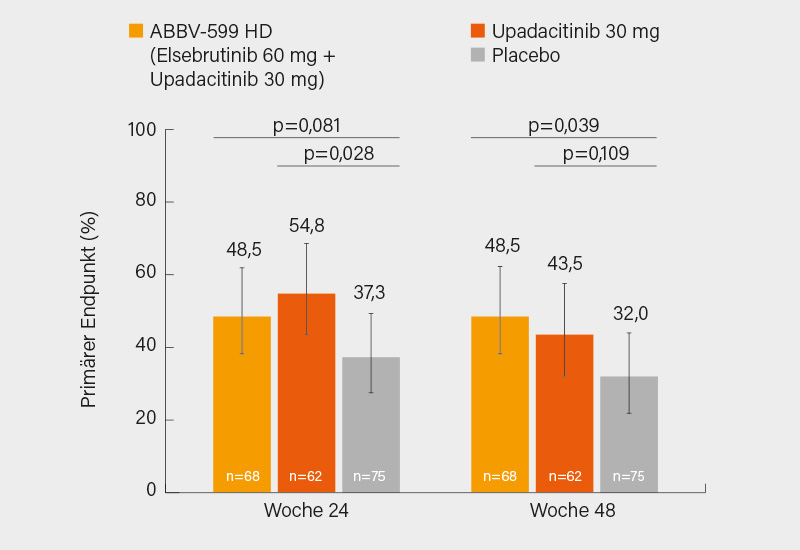
Der primäre Endpunkt in Woche 24 wurde sowohl von ABBV-599 HD (48,5 %) als auch Upadacitinib 30 mg (54,8 %) gegenüber Placebo (37,3 %) signifikant erreicht (p=0,081 bzw. p=0,028). In Woche 48 erreichten 48,5 und 43,5 vs. 32,0 % diesen kombinierten Endpunkt unter ABBV-599 HD, Upadacitinib 30 mg und Placebo, wurde allein das SRI-4-Ansprechen angelegt, waren es 51,5 % (Kombination) versus 45,2 % (Upadacitinib allein) sowie 32,0 % (Placebo) (Abb.). Zumeist signifikante Vorteile von ABBV-599 HD und Upadacitinib 30 mg zeigten sich in Woche 48 auch in Bezug auf das Ansprechen im BICLA (48,5 und 53,2 % vs. 25,3 %) und das Erreichen des LLDAS-Kriteriums für eine niedrige Krankheitsaktivität (39,7 und 50,0 vs. 24,0 %). Schübe und die Zeit bis zum ersten Schub (bis Woche 24 respektive 48) wurden jeweils substanziell reduziert mit der höchsten Schubrate unter Placebo (jeweils 2,8) und der geringsten unter ABBV-599 HD (1,7 bzw. 1,5), für Upadacitinib betrug sie 1,9 bzw. 2,0 – ohne signifikanten Unterschieden zwischen den aktiven Therapien. Es gab nur wenig schwere Schübe, diese meist unter Placebo. Anhaltspunkte für eine etwas bessere Wirksamkeit der Kombination ergaben sich hinsichtlich stärkerer Reduktionen des Anti-dsDNA-Antikörperspiegels und von Interferon-Gensignaturen, nicht aber der Komplement-Spiegel. Therapieassoziierte unerwünschte Ereignisse wurden bei 42,6 (ABBV-599 HD) und 32,3 % (Upadacitinib 30 mg) versus 33,3 % der Patienten unter Placebo verzeichnet. Es hab keine neuen Sicherheitssignale, keine Malignitäten und keine venösen Thromboembolien.
Als Fazit bleiben eine gute Wirksamkeit von Upadacitinib 30 mg/Tag bei SLE mit einer signifikanten Reduktion der Krankheitsaktivität und von Schüben über 48 Wochen. Nachdem (wie schon zuvor bei rheumatoider Arthritis) der BTK-Inhibitor Elsubrutinib allein oder auch in Kombination mit Upadacitinib (ABBV-599) keinen Zusatznutzen brachte, erübrigt sich eine weitere Exploration. Im Gegensatz dazu wird Upadacitinib derzeit im Phase-III SELECT-SLE-Programm (mit drei Substudien, geplant ist der Einschluss von ca. 1.000 Patienten) untersucht, mit den ersten Ergebnisse ist aber erst frühestens Ende 2026 zu rechnen.
Quelle: Arthritis Rheumatol 2024; doi: 10.1002/art.42926