Aus der in 24 Ländern durchgeführten Studie wurden die Daten bis Woche 52 (primäre Analyse) präsentiert, in der 428 Patienten ≥50 Jahre (im Mittel ca. 71 Jahre, 73 % Frauen) mit neu diagnostizierter oder rezidivierender RZA (70 vs. 30 %) nach Vortherapie mit ≥40 mg Prednison und Einnahme von ≥20 mg Prednison zu Baseline im 1:2:1-Design Upadacitinib 7,5 mg/Tag (n=107), Upadacitinib 15 mg/Tag (n=209) oder Placebo (n=112) in Kombination mit einem 26-wöchigen (Upadacitinib) oder 52-wöchigen (Placebo) GK-Tapering erhielten (keine vorherige Exposition auf JAK-Inhibitoren, oder auf IL-6-Inhibitoren binnen 4 Wochen vor Baseline, oder chronischer GK-Gebrauch). Der primäre Endpunkt war eine anhaltende Remission, definiert als keine Zeichen oder Symptome einer RZA von Woche 12-52 und ein protokollgerechtes GK-Tapering. Sekundäre Endpunkte waren eine anhaltende vollständige Remission (inkl. Normalisierung von ESR und CRP), Schübe, diverse PROs und die kumulative GK-Exposition bis Woche 52.
Gute Remissionsdaten nach 52 Wochen
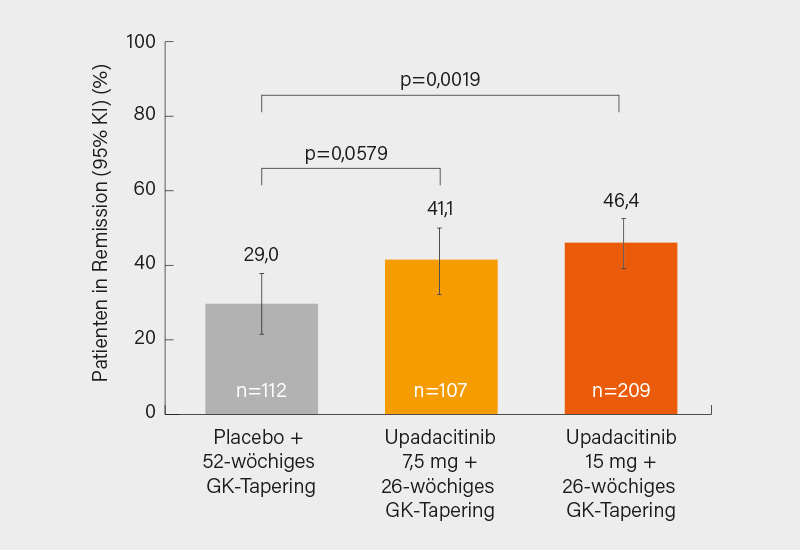
Der primäre Endpunkt einer anhaltenden Remission bis Woche 52 wurde mit Upadacitinib 15 mg versus Placebo signifikant erreicht (46,4 vs. 29,0 %, p=0,0019), nur im Trend traf dies auf die 7,5 mg-Dosis zu (41,1 %; p=0,0579) (Abb.), die auch (fast) alle anderen Endpunkte verfehlte (aber stets positiver Trend). Im Gegensatz dazu erreichte Upadacitinib 15 mg 9 von 11 multiplizitätskontrollierten sekundären Endpunkten einschließlich einer anhaltenden vollständigen Remission von Woche 12-52 (37,1 vs. 16,1 %; p<0,0001).
Upadacitinib 15 mg resultierte des Weiteren in einem gegenüber Placebo geringeren Risiko für mindestens einen Schub (definiert als Zeichen/Symptome einer RZA oder ESR >30 mm/h mit erforderlicher GK-Dosiserhöhung) über 52 Wochen hinweg (34,3 vs. 55,6 %; p<0,0014). Auch die Zeit bis zu einem ersten Schub war unter Upadacitinib 15 mg signifikant länger (unter Placebo median 46 Wochen, unter Upadacitinib nicht erreicht; Hazard Ratio, HR 0,57; p=0,0025). Die mediane kumulative GK-Exposition bis Woche 52 war erwartungsgemäß unter Upadacitinib 15 mg signifikant geringer als unter Placebo (1.615 vs. 2.882 mg; p<0,0001). Zusätzlich führte Upadacitinib 15 mg gegenüber Placebo zu einer signifikanten Verbesserung im FACIT-Fatigue-Score von Baseline bis Woche 52 (ΔLSM 1,7 vs. -2,4; p=0,0036). Die Sicherheit über 52 Wochen war in den Studienarmen vergleichbar (therapieassoziierte unerwünschte Ereignisse, TEAE/100 Patientenjahre: 817,7 unter 15 mg vs. 748,6 unter Placebo, schwere TEAE 36,5 vs. 42,4) mit numerisch höheren Raten an schweren Infektionen und schweren kardiovaskulären Ereignissen (MACE) unter Placebo und keinen MACE unter Upadacitinib. Herpes Zoster, Lymphopenie, Anämie und nicht-melanozytärer Hautkrebs (nicht aber Malignitäten insgesamt) waren unter Upadacitinib 15 mg numerisch häufiger im Vergleich zu Placebo.
Fazit
Im Ergebnis bot Upadacitinib 15 mg eine versus Placebo überlegene Effektivität in der Remissionsinduktion und GK-Reduktion – dies ohne neue Sicherheitssignale. Die Indikationserweiterung für den JAK-1-Inhibitor ist kürzlich erfolgt, wie genau sich Upadacitinib in den Therapiealgorithmus eingliedern wird (primär in Relation zu Tocilizumab), bleibt abzuwarten.
Quelle: N Engl J Med 2025; 392(20): 2013-2024