In der SELECT-PsA-1-Studie wurden 1.704 Patienten mit aktiver PsA (SJC/TJC ≥3), aktiver oder früherer Psoriasis und Versagen auf ≤2 csDMARDs im Verhältnis 1:1:1:1 auf Upadacitinib 1x 15 oder 30 mg/Tag, Adalimumab 40 mg s.c. alle 2 Wochen oder Placebo randomisiert. 53,2 % der Patienten waren Frauen, das mittlere Alter betrug 50,8 Jahre, die mittlere Zeit seit der PsA-Diagnose 6,1 Jahre, der SJC66/TJC68 betrug im Mittel 11 bzw. 20. 82 % der Studienteilnehmer waren auf ≥1 csDMARD, von diesen erhielten 84 % MTX mit oder ohne einem zusätzlichen csDMARD.
Gute Wirksamkeit auf alle Manifestationen
Primärer Endpunkt war das ACR20-Ansprechen in Woche 12 gegenüber Placebo, zusätzlich wurde gegenüber Adalimumab auch die Nicht-Unterlegenheit und Überlegenheit im ACR20-Ansprechen und auf die Überlegenheit im HAQ-DI und Schmerz (NRS) getestet. Sekundäre Endpunkte waren unter anderem in Woche 12 das ACR50/70-Ansprechen, in Woche 16 ein IGA Psoriasis-Score von 0/1 und PASI 75-Ansprechen sowie in Woche 24 die radiologische Progression im modifizierten Sharp/van der Heijde Score (mTSS), eine minimale Krankheitsaktivität (MDA) und die Resolution von Enthesitis (LEI=0) und Daktylitis (LDI=0).
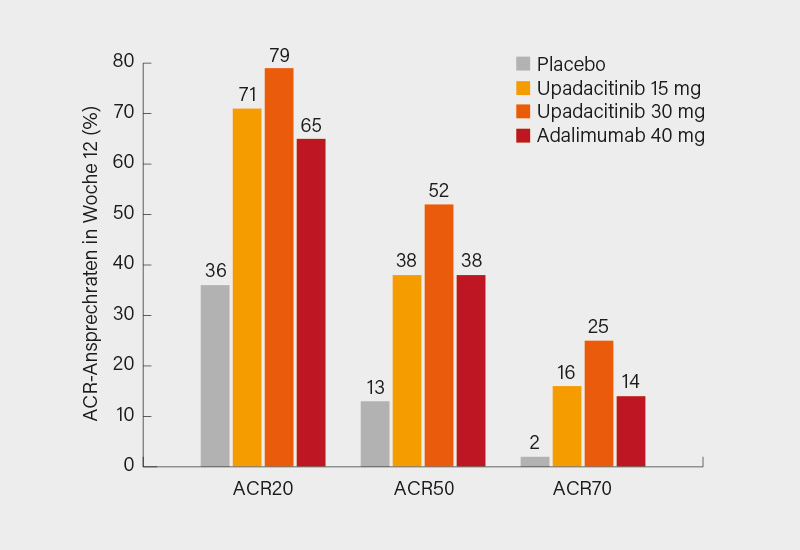
In Woche 12 betrug das ACR20-Ansprechen 70,6 bzw. 78,5 % unter Upadacitinib 15 und 30 mg versus 36,2 % unter Placebo (je p<0,001) und 65,0 % unter Adalimumab (je p<0,001 für Nicht-Unterlegenheit und p<0,001 für Überlegenheit der 30 mg-Dosierung). Auch im ACR50 bzw. 70-Ansprechen zeigten sich signifikante Vorteile von Upadacitinib gegenüber Placebo (37,5 bzw. 51,8 % vs. 13,2 % und 15,6 bzw. 25,3 % vs. 2,4 %), für die 30 mg-Dosierung war dies auch gegenüber Adalimumab (37,5 bzw. 13,8 %) erneut signifikant (Abb.). Bereits nach 2 Wochen waren deutliche Effekte evident. In allen weiteren sekundären Endpunkten fanden sich gleichfalls signifikante Verbesserungen durch den präferenziellen JAK-1-Inhibitor versus Placebo sowie für die 15- und 30 mg-Dosierung gegenüber Adalimumab im HAQ-DI und für die 30 mg-Dosierung versus Adalimumab in puncto Schmerz. Ein PASI 75-Ansprechen in Woche 16 wurde bei je ca. 62 vs. 21 bzw. 53 % der Teilnehmer verzeichnet, ähnlich war das sich bietende Bild auch im IGA-Score. In Woche 24 belief sich die Veränderung im mTSS auf -0,04 und 0,03 vs. 0,25 unter Placebo (p<0,001) sowie 0,01 unter Adalimumab. In Bezug auf Enthesitis erreichten eine Symptomfreiheit (LEI=0) 54 und 58 vs. 32 % unter Placebo bzw. 47 % unter Adalimumab, eine völlige Resolution der Daktylitis (LDI=0) würde bei 77 und 80 vs. 40 bzw. 74 % der Patienten dokumentiert, eine MDA erreichten 36 und 45 vs. 12 bzw. 33 %. Unerwünschte Ereignisse (UE) bis Woche 24 waren vergleichbar unter Upadacitinib 15 mg (66,9 %), Placebo (59,6 %) und Adalimumab (64,8 %), aber etwas häufiger im 30 mg-Arm (72,3 %). Bei schweren Infektionen war die Verteilung ähnlich mit 1,2, 0,9 und 0,7 % im Vergleich zu 2,6 % unter Upadacitinib 30 mg.
Im Ergebnis zeigt sich somit eine gute Wirksamkeit der zugelassenen 15 mg-Dosierung von Upadacitinib auf Gelenke und Haut mit dem bekannten Sicherheitsprofil. Im Vergleich zu Adalimumab ist dieses auf Augenhöhe, die mit etwas mehr Nebenwirkungen behaftete, nicht zugelassene 30 mg-Dosierung hatte sich sogar überlegen gezeigt. Im indirekten Vergleich scheint die IL-17/23-Schiene bei starker Hautbeteiligung stärker zu wirken, gegenüber TNFi ist Upadacitinib aber eine gleichwertige orale Therapiealternative.
Quelle: N Engl J Med 2021; 384(13): 1227-1239