In der im Vergleich zu SELECT-PsA 1, die auch einen direkten Vergleich mit Adalimumab beinhaltete, kleineren SELECT-PsA 2-Studie wurde Upadacitinib bei erwachsenen Patienten mit aktiver PsA (SJC ≥3 und TJC ≥3) gemäß den CASPAR-Kriterien und Versagen oder Intoleranz von ≥1 bDMARD untersucht. In der Studie wurden 642 Patienten (54 % Frauen, mittleres Alter 53 Jahre, Dauer seit PsA-Diagnose 10 Jahre) im Verhältnis 2:2:1:1 für 24 Wochen auf Upadacitinib 1x 15 oder 1x 30 mg/Tag oder Placebo randomisiert (stratifiziert nach csDMARD-Einnahme, Anzahl vorheriger bDMARDs und Grad der Psoriasis), danach wechselten die Placebo-Patienten auf Upadacitinib 15 oder 30 mg. 61 % der Teilnehmer hatten auf ein bDMARD versagt, 18 % auf zwei und 13 % auf ≥3, der mittlere SJC66 und TJC68 zu Baseline betrugen 12 bzw. 25. Primärer Endpunkt war das ACR20-Ansprechen in Woche 12, sekundäre Endpunkte waren z. B. das ACR50/70-Ansprechen, PASI 75/90/100-Ansprechen, das Erreichen einer minimalen Krankheitsaktivität (MDA) sowie die Resolution von Enthesitis und Daktylitis.
Gute Wirksamkeit auf Gelenke und Haut
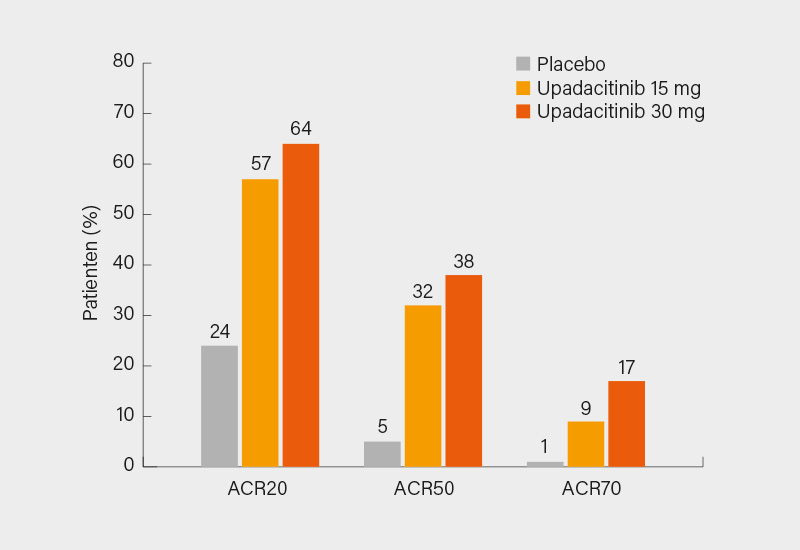
Im Ergebnis erreichten in Woche 12 signifikant mehr Patienten unter Upadacitinib 15 und 30 mg ein ACR20-Ansprechen (56,9 und 63,8 vs. 24,1 %; je p<0,0001). Ein vergleichbares Bild zeigte sich auch für das ACR50/70-Ansprechen (31,8 und 37,6 vs. 4,7 % bzw. 8,5 und 16,5 vs. 0,9 %; je p<0,05) (Abb.). Signifikant besser schnitten beide Upadacitinib-Arme auch in allen anderen sekundären Endpunkten in Woche 12 ab, so z. B. im ΔHAQ-DI (-0,30 und -0,41 vs. -0,10), ΔSF-36 PCS (5,2 und 7,1 vs. 1,6) und ΔFACIT-F (5,0 und 6,1 vs. 1,3) (je p<0,0001). Auch im Hautansprechen in Woche 24 (PASI 75/90/100: 53,8 und 62,6 vs. 19,1 %, 36,2 und 46,6 vs. 6,9 %, 22,3 und 33,6 vs. 4,6 %) sowie der Resolution von Enthesitis (LEI=0: 39 und 48 vs. 20 %) und Daktylitis (LDI=0: 64 und 76 vs. 36 %) in Woche 12 waren Upadacitinib 15 und 30 mg signifikant Placebo überlegen. Eine MDA in diesem schwierigen Patientenkollektiv erreichten in Woche 24 immerhin 25,1 und 28,9 vs. 2,8 % der Teilnehmer (je p<0,001).
Das Sicherheitsprofil von Upadacitinib entsprach den Erwartungen, alle und schwere therapieassoziierte unerwünschte Ereignisse (TEAE) traten etwas häufiger unter der 30 mg-Dosierung auf und waren vergleichbar unter Upadacitinib 15 mg und Placebo. Schwere Infektionen traten bei je 0,5 % (Placebo, Upadacitinib 15 mg) bzw. 2,8 % (30 mg) der Patienten auf, einen Herpes zoster entwickelten 0,9, 1,4 und 3,7 %.
Take-home-message: Sowohl bei auf csDMARDs- als auch bDMARDs versagenden PsA-Patienten zeigte sich Upadacitinib in allen Kerndomänen (Gelenke, Haut, Enthesitis und Daktylitis) Placebo signifikant überlegen und (in SELECT-PsA 1) zudem auf Augenhöhe mit Adalimumab. Die besten Therapieergebnisse wurden durchgehend mit der 30 mg-Dosierung erreicht, die sich in SELECT-PsA 1 auch Adalimumab überlegen zeigte (ACR20, HAQ-DI und Schmerz). Leider wurde diese nicht zugelassen, obwohl es trotz des etwas höheren Risikos für TEAE im Sinne einer individuellen Risiko/Nutzen-Abwägung wünschenswert gewesen wäre. Die Daten dieser und auch der SELECT-PsA 1-Studie sind positiv zu bewerten, lediglich im Hinblick auf das Hautansprechen ist zu konstatieren, dass hier voraussichtlich IL-17- und IL-23-Inhibitoren das Non-plus-Ultra bleiben werden.
Quelle: Ann Rheum Dis 2020; doi: 10.1136/annrheumdis-2020-218870