Vorgestellt wurden 24-Wochen-Daten der noch andauernden Phase-IIb-Dosisfindungsstudie zu dem gegen CD40 gerichteten monoklonalen Antikörper Iscalimab, in der dieser in 71 Zentren in 23 Ländern in zwei distinkten Patientenpopulationen mit moderater/schwerer systemischer Krankheitsaktivität (Kohorte 1) und niedriger systemischer Aktivität, aber hoher Krankheitslast (Kohorte 2), bei insgesamt 273 Patienten geprüft wurde.
In der Dosisfindungs-Kohorte 1 wurden 173 die 2016er ACR/EULAR-Klassifikationskriterien für SjS erfüllende Patienten (stimulierter Speichelfluss ≥0,1 ml/min., Anti-Ro/SSA-positiv) im Verhältnis 1:1:1:1 auf s.c. Iscalimab 150 mg, 300 mg oder 600 mg alle 2 Wochen (Q2W) oder auf Placebo randomisiert, in der Proof-of-concept-Kohorte 2 100 Patienten 1:1 auf die 600 mg-Dosis oder Placebo. Die Patienten in Kohorte 1 mussten sowohl einen EULAR Sjögren’s Syndrome Disease Activity Index (ESSDAI) ≥5 als auch EULAR Sjögren’s Syndrome Patient Reported Index (ESSPRI) ≥5 aufweisen, jene in Kohorte 2 hingegen einen ESSDAI <5 mit Aktivität in biologischer Domäre (>0) und einen ESSPRI (Fatigue oder Trockenheit) ≥5 sowie Impact Of Dry Eye On Everyday Life (IDEEL)-Score ≥30.
Iscalimab mit vielversprechenden Ergebnissen
Primäre Endpunkte waren der Nachweis einer Dosis-Wirkungsbeziehung gemäß der Veränderung im ESSDAI bis Woche 24 in Kohorte 1 und der Effektivität anhand der Veränderung des ESSPRI in Kohorte 2. Die Baseline-Charakteristika der Studienteilnehmer waren vergleichbar mit Ausnahme von Kohorte 1, in der mehr Patienten auf Iscalimab 300 mg schwer aktiv waren (ESSDAI >13; 44 %) und häufiger Hydroxychloroquin (HCQ,
70 %) im Vergleich zu den anderen Armen einnahmen (ESSDAI >13, 19-28 % und HCQ 47-64 %).
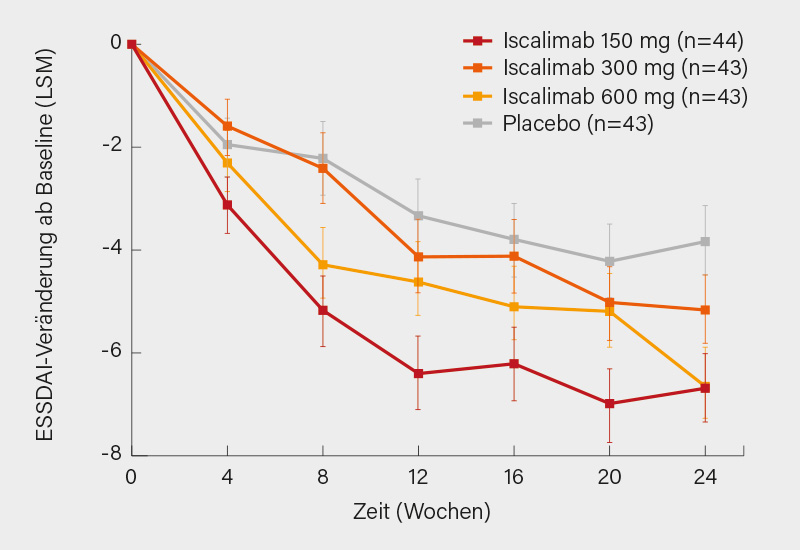
In Kohorte 1 zeigten sich im ΔESSDAI von Baseline bis Woche 24 jeweils signifikante Verbesserungen für die 150 mg- und 600 mg-Dosis von Iscalimab (Δ -3,0, 95% KI 4,9 bis -1,1; p=0,0025 bzw. Δ -2,9, 95% KI -4,9 bis -1,0; p=0,0037) und noch ein positiver Trend für die 300 mg-Dosis (Δ -1,4; p= 0,16) (Abb.). Das primäre Ziel einer Placebo-adjustierten Dosis-Wirkungs-Beziehung im ΔESSDAI von Baseline bis Woche 24 wurde signifikant erreicht (p=0,0041) mit einem Wirkplateau bei ≥150 mg. Im ESSPRI, FACIT-Fatigue-Score, Tränen- und Speichelfluss zeigten sich jeweils numerische Verbesserungen unter Iscalimab. In der Kohorte 2 wurde beim primären Kriterium des ΔESSPRI von Baseline bis Woche 24 mit der 600 mg-Dosis ein stark positiver Trend verzeichnet (Δ -0,57, 95% KI -1,30 bis 0,15; p=0,12) mit der Besserung von Trockenheit (Δ -1,0; p=0,016) und Fatigue (Δ -0,8; p=0,067) als den wichtigsten Treibern. Es wurde zudem ein signifikanter Anstieg des Speichelflusses gezeigt. Schwere unerwünschte Ereignisse traten bis Woche 24 bei 9 Patienten in Kohorte 1 auf (2 % unter Placebo vs. 2, 7 bzw. 9 % unter Iscalimab 150, 300 oder 600 mg) und 4 Patienten in Kohorte 2 (je 4 % in beiden Gruppen). Das Infektionsrisiko war unter Iscalimab nur minimal erhöht. Es wurden keine Todesfälle verzeichnet. Die Verträglichkeit war insgesamt gut.
In Verbindung mit den inzwischen auf dem EULAR 2024 vorgestellten 48-Wochen-Daten (mit Switch von Placebo auf Verum und vice versa) bewirkte der Anti-CD40-Antikörper bei guter Verträglichkeit in beiden SjS-Populationen eine klinisch bedeutsame Verbesserung, eine weitere Prüfung von Iscalimab in dieser Indikation wäre wünschenswert.
Quelle: Lancet 2024; 404(10452): 540-553