In der parallel auf dem ISN World Congress of Nephrology präsentierten und im NEJM publizierten Studie wurden 271 Patienten mit bioptisch gesicherter aktiver LN (Klasse III/IV mit/ohne begleitende Klasse V) zusätzlich zu einer Standardtherapie mit Mycophenolat Mofetil (MMF) sowie oralem Prednison mit einer Zieldosis von 7,5 mg/Tag bis Woche 12 und 5 mg/Tag bis Woche 24 im Verhältnis 1:1 auf Obinutuzumab in zwei Dosierschemata (1.000 mg an Tag 1 und in Woche 2, 24, 26 und 52, mit/ohne Dosis in Woche 50; n=135) oder Placebo (n=136) randomisiert. Primärer Endpunkt war ein vollständiges renales Ansprechen (CRR) in Woche 76, definiert als Urin-Protein-Kreatinin-Verhältnis (UPCR) <0,5 im 24 h-Sammelurin, geschätzte glomeruläre Filtrationsrate (eGFR) ≥85 % des Ausgangswertes und kein interkurrentes Ereignis (z. B. Rescue-Therapie, Therapieversagen, Tod oder vorzeitiger Studienabbruch). Zu den wichtigsten sekundären Endpunkten in Woche 76 gehörten ein CRR mit Prednison-Dosis ≤7,5 mg/Tag zwischen Woche 64 und 76 und ein UPCR <0,8 ohne interkurrentes Ereignis.
Vollständige Remission in fast 50 % der Fälle
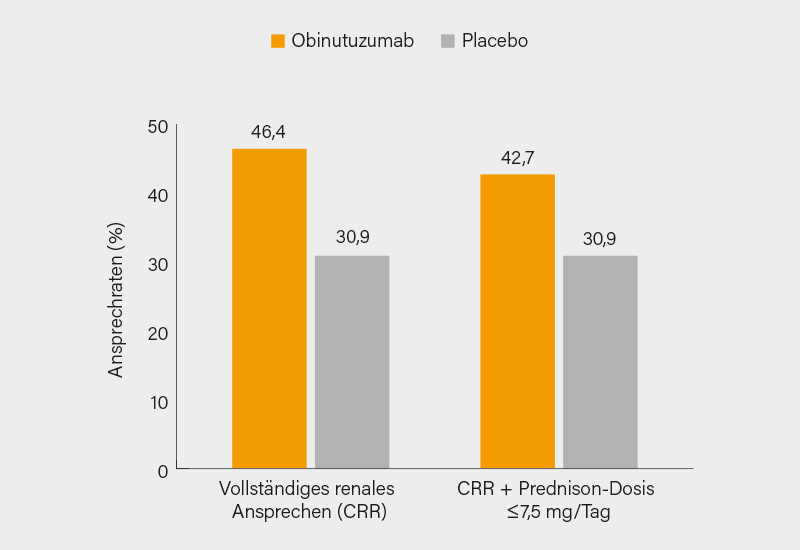
Den primären Endpunkt eines CRR in Woche 76 erreichten 46,4 % der Patienten unter Obinutuzumab gegenüber 33,1 % in der Placebo-Gruppe (adjustierte Differenz 13,4 %, 95% KI 2,0-24,8; p=0,02) (Abb.). Eine CRR in Woche 76 mit einer Prednison-Dosis ≤7,5 mg/Tag von Woche 64 bis 76 wurde bei mehr Patienten in der Obinutuzumab- als in der Placebo-Gruppe beobachtet (42,7 vs. 30,9 %, adjustierte Differenz 11,9 %, 95% KI 0,6-23,2; p=0,04) (Abb.), und auch ein UPCR <0,8 ohne interkurrentes Ereignis war unter Obinutuzumab häufiger als unter Placebo (55,5 vs. 41,9 %, adjustierte Differenz 13,7 %, 95% KI 2,0-25,4; p=0,02).
Positive Trends zugunsten von Obinutuzumab zeigten sich bei der Veränderung der eGFR (2,31 vs. -1,54 ml/min/1,73 m2), Tod oder renal-assoziierten Ereignissen (18,9 vs. 35,6 %), dem gesamten renalen Ansprechen (59,1 vs. 50,7 %) und im FACIT-Fatigue-Score (1,8 vs. 3,1). Überdies wurde ein Anstieg der Komplementfaktoren C3/C4, Rückgang des Anti-dsDNA-Antikörperspiegels und effektive B-Zell-Depletion (bei 95,1 % der Teilnehmer in Woche 76) beobachtet. In einer Subgruppenanalyse waren männliches Geschlecht (40 % höheres CRR vs. Frauen), eine 24 h-UPCR ≥3 vs. <3, Anti-dsDNA-Antikörperspiegel >120 vs. ≤120 IU/ml, C3 <0,9 vs. ≥0,9 g/l, C4 <0,1 vs. ≥0,1 g/l, Klasse IV vs. Klasse III LN, mit vs. ohne Klasse V LN und neu vs. früher diagnostizierte LN positive Baseline-Prädiktoren für ein gutes Ansprechen auf Obinutuzumab. Schwere unerwünschte Ereignisse, hauptsächlich Harnwegsinfektionen, Pneumonien, Gastroenteritis und COVID-19-Ereignisse, traten unter Obinutuzumab häufiger im Vergleich zu Placebo auf (32,4 vs. 18,2 %), unerwartete Sicherheitssignale wurden nicht verzeichnet.
Bei erwachsenen Patienten mit aktiver Lupus Nephritis war Obinutuzumab zusätzlich zu einer Standardtherapie signifikant wirksamer als diese allein in Hinblick aus das Erreichen eines vollständigen renalen Ansprechens, also Remission, bei zugleich möglicher Reduktion der Prednison-Dosis – die Ergebnisse aus Phase-II bestätigend. Von einer Zulassung in dieser Indikation (bei chronisch lymphatischer Leukämie und follikulärem Lymphom ist Obinutuzumab bereits etabliert) ist recht sicher auszugehen. Eine Phase-III-Studie bei SLE namens ALLEGORY läuft derzeit noch.
Quelle: N Engl J Med 2025; doi: 10.1056/NEJMoa2410965