Zunächst lohnt sich allerdings ein genauerer Blick auf die Strategiestudie CONTROL. Die minimale Krankheitsaktivität (MDA) ist bei PsA ein valides Treat-to-target (T2T)-Kriterium. Der Teil 1 der internationalen, randomisierten, open-label Phase-IV-Studie CONTROL mit 246 erwachsenen bDMARD-naiven Patienten (50 % Frauen, in Mittel 50 Jahre) mit aktiver PsA (keine MDA, SJC/TJC ≥3 3, im Mittel SJC/TJC 11 bzw. 22) hatte gezeigt, dass nach einem initialen Therapieversuch mit Methotrexat (MTX) 15 mg für ≥4 Wochen die Kombination mit Adalimumab 40 mg alle 2 Wochen gegenüber einer Eskalation der MTX-Dosis auf 20-25 mg/Woche oder die höchste tolerierte Dosis (im Mittel 21,8 mg, 55 % orales MTX) nach 16 Wochen in einem signifikant häufigeren Erreichen einer MDA resultierte (41,5 vs. 13,1 %; p<0,001).
Neue Daten aus Strategiestudie CONTROL
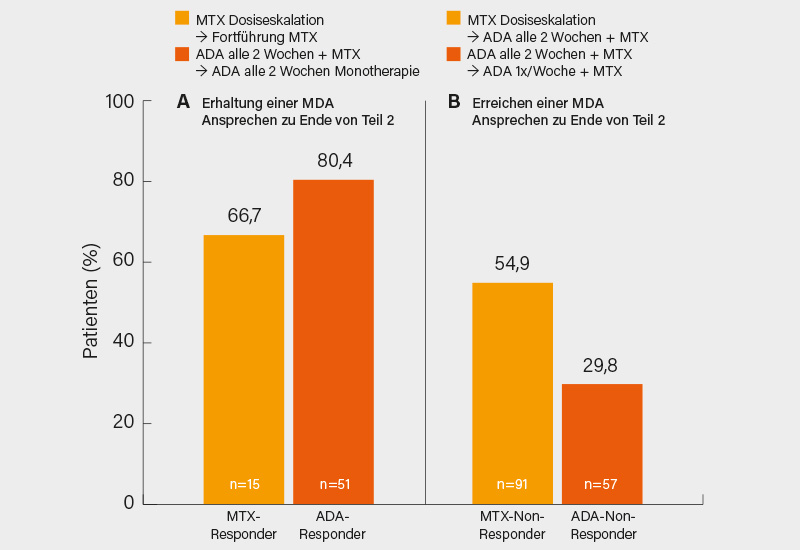
Im jetzt von Philip J. Mease, Seattle (USA), und Kollegen vorgestellten Teil 2 der CONTROL-Studie (Woche 16-32) war die Therapie auf Basis des MDA-Ansprechens fortgesetzt oder modifiziert worden. So wurde bei Patienten der Adalimumab/MTX-Gruppe mit MDA in Woche 16 (n=54) MTX abgesetzt und Adalimumab in Monotherapie weitergeführt, während bei jenen, die darunter keine MDA erreicht hatten (n=63), die Kombination bei Eskalation auf Adalimumab 40 mg/Woche fortgeführt wurde. Jene Patienten der MTX-Eskalationsgruppe, die eine MDA in Woche 16 erreicht hatten (n=15), führten dieses mit der eskalierten Dosis fort, jene, die dieses Ziel nicht erreichten (n=95), wurden auf Adalimumab 40 mg alle 2 Wochen plus MTX 20-25 mg oder die höchste tolerierte Dosis eskaliert.
In Woche 32 waren 80 % der Adalimumab-Responder (bei denen MTX abgesetzt wurde) im MDA-Status im Vergleich zu 67 % der MTX-Responder, die ihre Therapie bis zum Ende der 2. Studienphase beibehielten. Umgekehrt erreichten von den MTX-Non-Respondern, die ab Woche 16 auf die Kombination mit Adalimumab eskaliert wurden, 55 % eine MDA in Woche 32, während dies bei den Adalimumab-Non-Respondern, deren Adalimumab-Dosis auf 1x wöchentlich eskaliert wurde, zu 30 % gelang (Abb. 1). In den jeweiligen Gruppen wurden bei 44,4 und 66,7 % (Adalimumab-Responder bzw. Non-Responder) sowie 33,3 bzw. 56,8 % (MTX-Responder bzw. Non-Responder) unerwünschte Ereignisse (UE) verzeichnet, schwere UE waren jeweils selten (<5 %). Es gab weder opportunistische Infektionen, Todesfälle noch neue Sicherheitssignale. Bei Patienten mit MDA-Ansprechen in Teil 1 blieb die Effektivität somit in Teil 2 weitgehend erhalten trotz einer Reduktion der Erhaltungstherapie bei den Adalimumab-Respondern, die numerisch in Woche 32 das beste Ansprechen aufwiesen. Bei den ursprünglichen Non-Respondern wurde nach Therapieeskalation bei deutlich mehr Patienten eine MDA erzielt. (1)
Erste Daten zur oralen TYK-2-Inhibition bei der aktiven PsA
Bislang sind im Hinblick auf tsDMARDs die JAK-Inhibitoren in der Rheumatologie allein auf weiter Flur, umso mehr nachdem zwei Bruton’s Tyrosin-Kinase (BTK)-Inhibitoren sowohl bei RA als auch SLE enttäuschten. Mit dem selektiven TYK-2-Inhibitor Deucravacitinib, der den JAK-Inhibitoren nahe verwandt ist, könnte sich das künftig ändern. In einer Phase-II-Studie zur Plaque-Psoriasis hatten beachtliche 67-75 % der Patienten unter Deucravacitinib 2x ≥3 mg/Tag in Woche 12 ein PASI 75-Ansprechen erreicht (vs. 7 % unter Placebo), ohne dass es zu schwerwiegenden UE kam. Als Late-breaking Abstract präsentierte nun wiederum Philip J. Mease die Ergebnisse einer randomisierten, doppelblinden, placebokontrollierten Phase-II-Studie zu Deucravacitinib bei aktiver PsA. In die noch laufende 1-Jahres-Studie (placebokontrolliert bis Woche 16) wurden 203 Patienten mit aktiver PsA (gemäß CASPAR-Kriterien, SJC/TJC je ≥3, CRP ≥3 mg/l und ≥1 psoriatische Läsion ≥2 cm) eingeschlossen, die auf ≥1 NSAR, Kortikosteroid und/oder csDMARD oder einen TNFα-Inhibitor (≤30 %) versagt oder diese nicht vertragen hatten. Diese erhielten im Verhältnis 1:1:1 randomisiert Deucravacitinib 1x 6 mg/Tag oder 1x 12 mg/Tag oder Placebo. Primärer Endpunkt war das ACR20-Ansprechen in Woche 16, sekundäre Endpunkte Verbesserungen ab Baseline im HAQ-DI und der physischen Komponente im SF-36 (PCS). Insgesamt 89 % der Teilnehmer (im Mittel 50 Jahre, Krankheitsdauer 4,5 Jahre, 66 % csDMARDs und 15 % mit vorheriger Anti-TNF-Therapie) schlossen die ersten 16 Wochen ab.
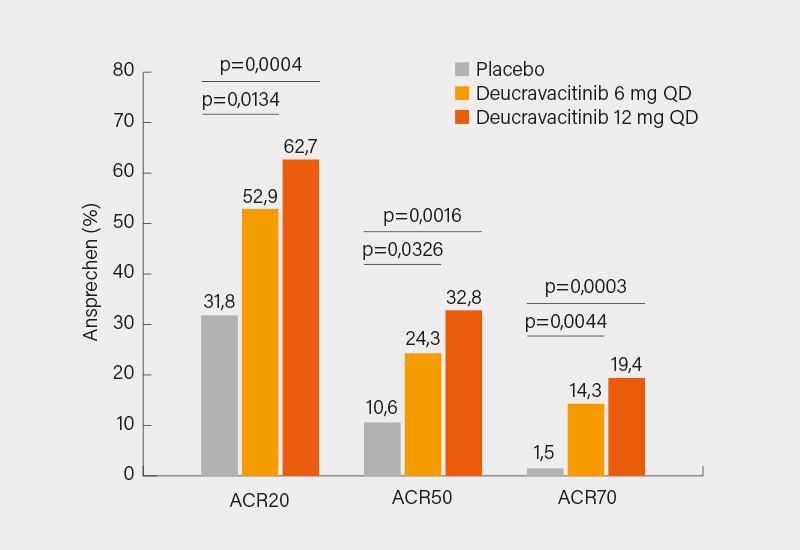
Der primäre Endpunkt wurde mit dem Nachweis einer Dosis-Wirkungs-Beziehung signifikant erreicht (p<0,001). Sowohl unter Deucravacitinib 6 mg (n=70) als auch 12 mg (n=67) wurde mit 52,9 bzw. 62,7 vs. 31,8 % unter Placebo (n=66) signifikant öfter ein ACR20-Ansprechen in Woche 16 erreicht. Im ACR50/70-Ansprechen zeigten sich gleichfalls signifikante Vorteile von Deucravacitinib (24,3 und 32,8 vs. 10,6 % bzw. 14,3 und 19,4 vs. 1,5 %) versus Placebo (Abb. 2). Auch im Hinblick auf die körperliche Funktion schnitten beide Dosierungen von Deucravacitinib gegenüber Placebo signifikant besser ab (ΔHAQ-DI -0,37 und -0,39 vs. -0,11; p=0,0020 bzw. 0,0008; ΔSF-36 PCS 5,6 und 5,8 vs. 2,3; p=0,0062 bzw. 0,0042). Ein HAQ-DI-Ansprechen fand sich bei 38,6 und 40,3 vs. 15,2 % (je p<0,002) der Patienten, eine Resolution der Enthesitis gemäß Leeds Enthesitis Index (LEI) bei 51,3 und 50,0 vs. 22,6 % (je p<0,04) und eine MDA in Woche 16 erreichten 22,9 und 23,9 vs. 7,6 % (je p<0,02). Die häufigsten UE unter Deucravacitinib waren Nasopharyngitis, Sinusitis, Kopfschmerzen und Hautausschläge, meistens waren diese mild bis mäßig stark ausgeprägt. Jedoch wurden erneut keine schwerwiegenden UE wie schwere Infektionen, Herpes zoster, opportunistische Infektionen oder thrombotische Ereignisse verzeichnet. (2)
Für eine genauere Bewertung ist es noch zu früh, gerade die Wirksamkeit der höheren Dosierung kann sich bislang aber sehen lassen. Interessant dürfte zu sehen sein, wie es sich im Langzeitverlauf und folgenden Studien mit dem bis dato sehr positiven Sicherheits- und Verträglichkeitsprofil verhält.
Upadacitinib auch bei axialer PsA-Symptomatik effektiv
Primär für den IL-17A-Inhibitor Secukinumab (MAXIMISE-Studie), aber auch für den IL-23-Inhibitor Guselkumab (gepoolte DISCOVER-1/-2-Analyse) konnte eine Wirksamkeit auch auf axiale Symptome einer PsA demonstriert werden, die mit einer höheren Krankheitsaktivität und schlechteren Lebensqualität assoziiert sind. Offenbar gilt dies auch für den JAK-1-Inhibitor Upadacitinib, der bei ankylosierender Spondylitis (AS) nach NSAR-Versagen eine gute Effektivität in einer Phase-II/III-Studie gezeigt hatte. Atul Deodhar, Portland (USA), stellte nun eine entsprechende Analyse zu dessen beiden Phase-III-Studien bei der PsA vor.
In SELECT-PsA 1 (n=1.705, nach csDMARD-Versagen) and SELECT-PsA 2 (n=642, auch bDMARD-Versagen) waren Patienten mit aktiver PsA (SJC/TJC je ≥3), aktiver oder früherer Psoriasis und Versagen auf ≤2 csDMARDs auf Upadacitinib 15 mg oder 30 mg, Adalimumab 40 mg alle 2 Wochen (nur in SELECT-PsA 1) oder Placebo randomisiert worden. Zu Baseline war auch eine psoriatische Spondylitis nach Urteil der Studienärzte erfasst worden. Auf Basis gepoolter Daten beider Studien wurde die Effektivität von Upadacitinib (versus Placebo) bis Woche 24 bei PsA-Patienten mit axialer Beteiligung bewertet, so etwa gemäß BASDAI, ASDAS-CRP, BASDAI 50-Ansprechen, ASDAS inaktive Erkrankung (ID), ASDAS niedrige Krankheitsaktivität (LDA) und ASDAS deutliche oder klinisch bedeutsame Verbesserung (MI, CII). Eine axiale Beteiligung lag bei 31,3 % der Patienten in SELECT-PsA 1 und 34,2 % in SELECT-PsA 2 vor, eine solche war mit einer höheren Krankheitslast zu Baseline assoziiert.
Upadacitinib 15 und 30 mg/Tag waren von Baseline bis Woche 24 (und auch bereits Woche 12) mit signifikant größeren Verbesserungen im BASDAI (Δ-2,61 bzw. -2,71 vs. -1,00) und ASDAS-CRP (Δ-1,53 bzw. -1,70 vs. -0,41) verbunden (je p<0,001). Gleiches galt in Woche 24 auch für das BASDAI 50-Ansprechen (49,3 bzw. 47,1 vs. 18,5 %), eine ASDAS ID (37,2 bzw. 43,2 vs. 9,3 %), ASDAS LDA (57,7 bzw. 65,0 vs. 22,0 %), ASDAS MI (34,9 bzw. 38,3 vs. 5,9 %) und ASDAS CII (56,3/59,2 vs. 20,5 %) (alle p<0,001). Es kam unter Upadacitinib weder zu einem Anstieg der Uveitis-Rate noch CED-assoziierten Ereignissen. Konsistent mit den Daten zu AS-Patienten zeigte sich Upadacitinib somit auch wirksam in der Behandlung axialer Symptome einer PsA. (3)
ACHILLES-Studie: Daten zu Secukinumab bei Enthesitis
Eine Enthesitis ist eine schmerzhafte Manifestation der PsA und axialen Spondyloarthritis (axSpA), die erheblich zur Krankheitslast beiträgt und für die positive Effekte der Inhibition von IL-17, IL-23 und TNF in diesen Indikationen belegt sind. Nachdem für den IL-17A-Inhibitor Secukinumab zuvor eine signifikante Reduktion der enthesialen Entzündung bei PsA-Patienten nachweisbar war, wurde in der von Frank Behrens, Frankfurt/M., vorgestellten 52-wöchigen internationalen, randomisierten, placebokontrollierten Phase-IIIb-Studie ACHILLES in einer heterogenen Population von PsA- und axSpA-Patienten die Effektivität von Secukinumab in der Therapie einer Achillessehnen-Enthesitis untersucht. 204 Patienten ≥18 Jahre mit aktiver PsA (CASPAR-Kriterien, SJC/TJC ≥1; n=128) oder axSpA (ASAS-Kriterien, BASDAI ≥4; n=76) und MRT-positiver Fersenenthesitis nach Beurteilung der Studienärzte, die zuvor auf NSAR bzw. Anti-TNF-Therapien nicht ansprachen, wurden im Verhältnis 1:1 auf s.c. Secukinumab 150 mg bzw. 300 mg oder Placebo zu Baseline und in Woche 1, 2, 3 und 4 und danach alle 4 Wochen randomisiert. In Woche 24 wechselten auch die Placebo-Patienten auf Secukinumab 150 oder 300 mg. Primärer Endpunkt war der Anteil von Patienten mit einer Resolution der Achillessehnen-Enthesitis des betroffenen Fußes in Woche 24 (gemäß der Subkomponente des LEI). Zusätzlich erfasst wurden in Woche 24 und 52 u. a. der LEI, Fersenschmerz (NRS 0-10) und das Arzt-/Patientenurteil zur Aktivität der Fersen-Enthesiopathie und globalen Krankheitsaktivität (VAS 0–100).
Den primären Endpunkt einer Resolution der Achillessehnen-Enthesitis des betroffenen Fußes (42,2 vs. 31,4 %; p=0,136) und im LEI (33,3 vs. 23,5 %; p=0,148) erreichten in Woche 24 nur numerisch mehr der mit Secukinumab behandelten Patienten. Eine signifikant größere Verbesserung im LEI wurde unter Secukinumab bei den PsA-Patienten verzeichnet (35,9 vs. 18,8 %; p=0,025). Auch Patienten mit einem BMI <30 kg/m2 profitierten beträchtlich stärker von Secukinumab (49,2 vs. 24,6 %). Signifikante Vorteile des IL-17A-Inhibitors im Vergleich zu Placebo in Woche 24 zeigten sich beim Rückgang von Fersenschmerzen (-2,7 vs. -1,9; p=0,027) und jeweils in der Arzt-/Patientenbewertung der globalen und enthesialen Krankheitsaktivität. Bis Woche 52 kam es zu einer Zunahme der Effektivität. So erreichten unter fortgeführter Secukinumab-Therapie 58 bzw. 48 % der Patienten eine Resolution der Achillessehnen-Enthesitis des betroffenen Fußes bzw. im LEI. Trotz Verfehlen des primären Endpunkts zeigte sich somit bei therapierefraktären SpA-Patienten eine signifikante Verbesserung der Fersenenthesitis und deren Krankheitslast unter dem IL-17A-Inhibitor. (4)
Quellen:
1 Arthritis Rheumatol 2020; 72(Suppl. 10): Abstr. 0508
2 Arthritis Rheumatol 2020; 72(Suppl. 10): Abstr. L03
3 Arthritis Rheumatol 2020; 72(Suppl. 10): Abstr. 1372
4 Arthritis Rheumatol 2020; 72(Suppl 10): Abstr. 0882