In der CREDO2-Studie, deren Erstpräsentation zuvor auf dem ACR-Kongress 2021 erfolgte, wurden 1.648 Patienten mit aktiver RA und unzureichendem Ansprechen auf MTX (im Mittel 54 Jahre, 78 % Frauen, Krankheitsdauer >7 Jahre, DAS28-CRP-Score 5,9) im Verhältnis 2:2:2:1 für 24 Wochen auf s.c. Olokizumab 64 mg alle 2 (q2w; n=464) bzw. alle 4 Wochen (q4w; n=479), Adalimumab 40 mg q2w (n=462) oder Placebo (n=243) randomisiert (jeweils in Kombination mit MTX), danach folgte noch ein 20-wöchiges Follow-up.
Primärer Endpunkt war das ACR20-Ansprechen in Woche 12, wobei einerseits jede Olokizumab-Dosis auf Überlegenheit gegen Placebo und andererseits auf Nicht-Unterlegenheit gegen Adalimumab geprüft wurde (mit einer Nicht-Unterlegenheitsmarge von -12 Prozentpunkten an der unteren Grenze des 97,5 %-Konfidenzintervalls zwischen beiden Gruppen). Sekundäre Endpunkte in Woche 12 waren u. a. ein DAS28-CRP-Score <3,2 und ΔHAQ-DI, sowie in Woche 24 ein ACR50-Ansprechen und CDAI ≤2,8.
Nach MTX-Versagen auf Augenhöhe mit Adalimumab
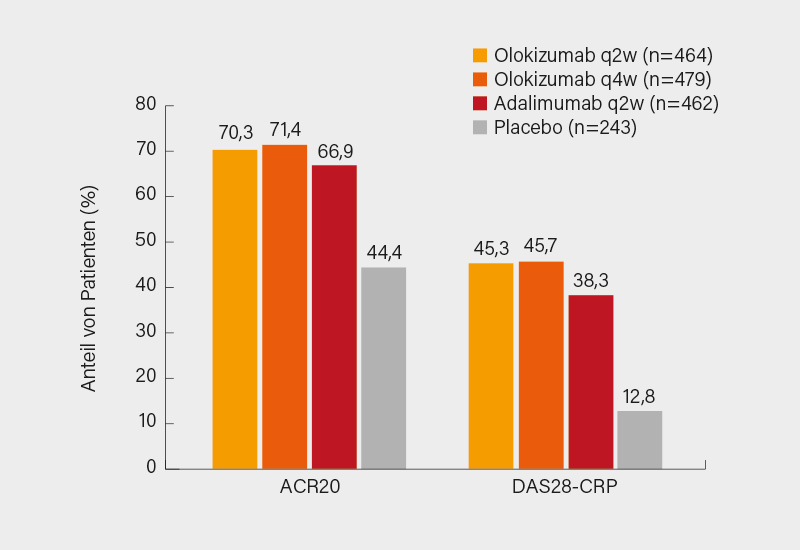
Gut 90 % der Patienten schlossen die 24-wöchige Phase ab, und ca. 86 % gingen in das Follow-up ein. Beide Olokizumab-Regime zeigten sich Placebo im primären Endpunkt ACR20 signifikant überlegen (je p<0,001) und gegenüber Adalimumab nicht unterlegen (mit teilweise numerischen Vorteilen). Ein ACR20-Ansprechen in Woche 12 erreichten 70,3 % (q2w), 71,4 % (q4w), 66,9 % (Adalimumab) und 44,4 % (Placebo) der Patienten (Abb. li.). Ein ACR20-Ansprechen hatten nach 2 Wochen bereits 35-45 % der Patienten erzielt, nach ca. 8 Wochen wurde ein Plateau erreicht, das höchste Ansprechen zeigte sich in Woche 18. Auch in den sekundären Endpunkten wurden durchweg signifikante Vorteile gegenüber Placebo (fast immer p<0,001) sowie eine Gleichwertigkeit mit Adalimumab dokumentiert. So erreichten einen DAS28-CRP <3,2 45,3 und 45,7 % vs. 38,3 und 12,8 % der Patienten (Abb. re.). In Woche 24 betrug das ACR50-Ansprechen 50,4 und 50,1 % vs. 46,3 bzw. 22,6 %, eine CDAI-Remission ≤2,8 erreichten 11,2 und 12,1 % vs. 13,0 bzw. 4,1 % der Teilnehmer.
Bei 3,8 (q2w) bzw. 5,1 % (q4w) der Patienten unter Olokizumab kam es zur Bildung von Anti-Drug-Antikörpern. Zu therapieassoziierten unerwünschten Ereignissen (TEAE), überwiegend Infektionen, kam es bei 70,0 und 70,9 % vs. 65,4 (Adalimumab) bzw. 63,4 % (Placebo), zum Abbruch führten diese bei 4,5 und 6,3 % vs. 5,6 bzw. 3,7 %. Es verstarben 5 Patienten unter Olokizumab (je ein hämorrhagischer Schlaganfall und Myokardinfarkt sowie 3 aufgrund von Infektionen), unter Adalimumab (Infektion) und Placebo (plötzlicher Herztod) je ein Patient, was aber aufgrund der geringen Fallzahlen nur eine limitierte Aussagekraft hat.
Das Sicherheitsprofil scheint jenem der IL-6-Rezeptorinhibitoren ähnlich zu sein (höheres LDL-Cholesterin, Anstieg von Leberwerten). Somit kann Olokizumab eine gute Wirksamkeit auf Augenhöhe mit Adalimumab attestiert werden, bei recht guter Verträglichkeit gab es keine neuen Sicherheitssignale. (1)
Gute Wirksamkeit auch nach Versagen auf Anti-TNF-Therapie
Etwas kleiner war die CREDO3-Studie, in die 368 Patienten mit mäßiger bis schwerer aktiver RA und unzureichendem Ansprechen auf TNFa-Inhibitoren (im Mittel 53 Jahre, >80 % Frauen, Krankheitsdauer ca. 11 Jahre, DAS28-CRP 6,0) eingeschlossen wurden. Diese wurden zusätzlich zu MTX im Verhältnis 2:2:1 für 24 Wochen auf s.c. Olokizumab 64 mg q2w bzw. q4w oder Placebo randomisiert. Der primäre und die sekundären Endpunkte waren identisch mit jenen in CREDO2, wurden aber alle in Woche 12 erfasst.
Beide Olokizumab-Regime waren im primären Endpunkt (ACR20 in Woche 12) Placebo signifikant überlegen (60,9 und 59,6 vs. 40,6 %; p=0,03 bzw. 0,04), ebenso im DAS28-CRP ≤3,2 (39,9 und 28,0 vs. 11,6 %; p<0,001 bzw. =0,004). Die Unterschiede im ΔHAQ-DI waren bis Woche 12 nur für das 2-wöchentliche Regime signifikant. Ein ACR50-Ansprechen und einen CDAI ≤2,8 in Woche 12 erreichten 33,3 und 32,3 vs. 15,9 % bzw. 6,5 und 3,1 vs. 0 % der Patienten. TEAE waren unter Olokizumab q2w und q4w etwas häufiger als unter Placebo (65,5 und 65,0 vs. 50,7 %), zu schweren TEAE (meist Infektionen) kam es bei 7,0 und 3,2 vs. 0 %. Schwere opportunistische Infektionen, kardiovaskuläre Ereignisse, gastrointestinale Perforationen oder Todesfälle wurden nicht verzeichnet. Die Wirksamkeit und Sicherheit von Olokizumab waren somit auch in dieser Phase-III-Studie gut. (2)
Zulassungsanträge für Olokizumab bei RA in Europa und den USA sind offenbar für das kommende Jahr geplant, in Russland, wo der IL-6-Inhibitor entwickelt wurde, ist er bereits seit 2020 (auf Basis der kleineren CREDO1-Studie) zugelassen. Ob sich hier womöglich noch Hürden aufgrund der bestehenden Sanktionen auftun, bleibt abzuwarten, ansonsten sprechen aber sowohl die Wirksamkeit als auch das Sicherheitsprofil klar für eine Zulassung. Im (indirekten) Vergleich zu den etablierten IL-6-Rezeptorinhibitoren ist nicht von einer höheren Effektivität auszugehen, was sich aber nur in einer Head-to-head-Studie klären ließe.
Quellen:
1 N Engl J Med 2022; 387(8): 715-726
2 Ann Rheum Dis 2022; doi: 10.1136/ard-2022-222630