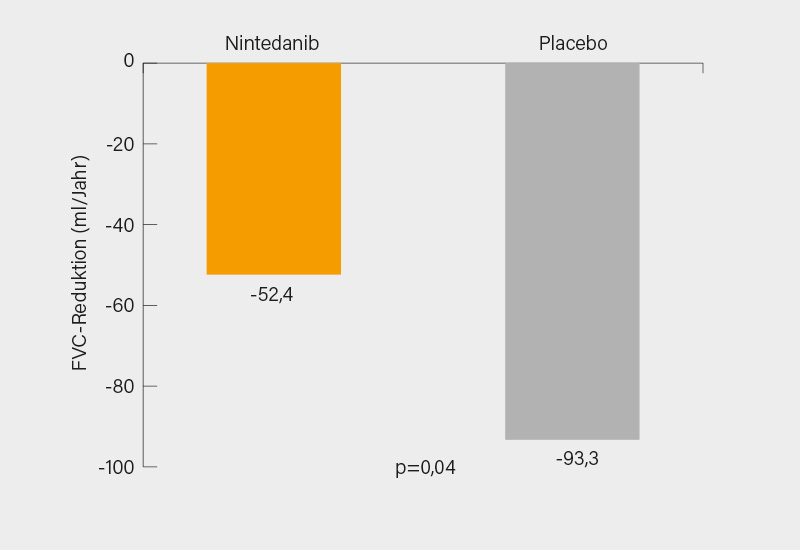
In die von Oliver Distler, Zürich (Schweiz), vorgestellte randomisierte, doppelblinde, placebokontrollierte SENSCIS-Studie waren 576, relativ praxistypische SSc-ILD-Patienten (ca. 50 % diffus-kutane SSc, mittlere Krankheitsdauer ≤7 Jahre, Fibrose im HRCT ≥10 %, FVC ≥40 %, DLCO 30-89 %) eingeschlossen und auf dem Boden einer stabilen Hintergrundtherapie mit Prednison ≤10 mg/Tag, Methotrexat, Mycophenolat Mofetil (MMF; in 48 % der Fälle) auf 2x 150 mg/Tag Nintedanib oder Placebo randomisiert worden. Primärer Endpunkt war der FVC-Verlust (ml/Jahr) über 52 Wochen. Wichtige sekundäre Endpunkte waren die Hautfibrose (ΔmRSS) nach 52 Wochen sowie die Dyspnoe-spezifische Lebensqualität gemessen an der Änderung des St. Georges Respiratory Questionnaire (SGRQ)-Scores nach 52 Wochen gegenüber Baseline.
Der primäre Endpunkt wurde signifikant erreicht. Nach 52 Wochen betrug der adjustierte Verlust an forcierter Vitalkapazität unter Nintedanib -52,4 ml/Jahr im Vergleich zu -93,3 ml/Jahr unter Placebo (p=0,04) (Abb. 1). Dies entspricht einer relativen Differenz von 44 %, was – bei naturgemäß allerdings absolut geringeren Zahlen – den Ergebnissen der Phase-III-Studien zu Nintedanib bei idiopathischer Lungenfibrose (IPF) entspricht. (1) Der Wirkeffekt war bereits nach 12 Wochen erkennbar. Von Nintedanib profitierten alle untersuchten Subgruppen, wobei als interessanter Nebenbefund die sehr gute Wirksamkeit von MMF auffällt. Bei zusätzlich damit behandelten Patienten betrug der FVC-Verlust unter Nintedanib gegenüber Placebo -40,2 vs. -66,5 ml/Jahr, ohne MMF waren es -63,9 vs. -119,3 ml/Jahr. (2) Dass eine signifikante Verbesserung des mRSS nach 52 Wochen verfehlt wurde (absolute Differenz vs. Placebo -0,21; p=0,58), könnte wie in anderen Studien auch einer zu geringen Studiendauer geschuldet sein, die Indifferenz im SGRQ-Score in Monat 12 ist womöglich dem Umstand geschuldet, dass die Lungenfibrose und damit Dyspnoe in diesem Kollektiv (noch) nicht ausgeprägt genug waren. Trotz des noch nicht final abschätzbaren klinischen Nutzens ist sicher von einer Zulassung auszugehen, dabei dürfte dann das Hauptproblem im sorgfältigen Management gastrointestinaler Nebenwirkungen bestehen: Bei 76, 32 und 25 % der Patienten kam es unter Nintedanib zu Diarrhö, Übelkeit und Erbrechen, was in 26 % der Fälle eine Dosisreduktion und in 9 % sogar einen Therapieabbruch erzwang. (3)
Weitere Studienergebnisse im Überblick
Das wie Nintedanib bei IPF bereits zugelassene Pirfenidon wurde von einer indischen Studiengruppe ebenfalls randomisiert-kontrolliert untersucht bei allerdings nur 34 SSc-ILD-Patienten und dies auch nur für sechs Monate. Weder bezüglich FVC, Dyspnoe noch Hautfibrose konnten signifikante Unterschiede gegenüber Placebo ermittelt werden. (4) Interessant ist in diesem Kontext die auf dem ACR 2018 vorgestellte Phase-III-Studie focuSSced zu Tocilizumab 162 mg s.c. bei Patienten mit rasch-progredienter SSc. Eine jetzt in Madrid neu vorgestellte Analyse verdeutlicht, dass trotz des verpassten primären Endpunkts (∆mRSS in Woche 48) wie schon zuvor in Phase-II ein signifikanter Vorteil im Hinblick auf die FVC (Δ167 ml vs. Placebo) mit sogar – anders als im Falle von Nintedanib – dem Erhalt der Lungenfunktion gegeben war (Abb. 2). Eine geringere Progression der Lungenfibrose bestätigte sich im HRCT. (5) Auch wenn Quervergleiche zur SENSCIS-Studie aufgrund der unterschiedlichen Kollektive wenig Sinn machen, wäre eine neue Studie zu dem IL-6-Inhibitor bei originären SSc-ILD-Patienten sicherlich wünschenswert. Kurz erwähnt sei noch die Analyse einer Phase-IIb-Studie zu dem sGC-Stimulator Riociguat bei Patienten mit früher diffus-kutaner SSc, in der sich in der Subgruppe von Teilnehmern mit SSc-ILD ebenfalls Hinweise auf einen Erhalt der Lungenfunktion fanden. (6)
Kurz erwähnt sei abschließend noch eine von Anna-Maria Hoffmann-Vold, Oslo (Norwegen), präsentierte randomisierte, doppelblinde, placebokontrollierte, 16-wöchige Pilotstudie, in der 10 Frauen mit limitiert-kutaner SSc und gastrointestinalen (GI)-Beschwerden eingeschlossen wurden. Im Verhältnis 1:1 erhielten diese einen fäkalen Mikrobiomtransfer (FMT) oder Placebo. Auch wenn nicht ganz klar ist, ob die Dysbiose Auslöser oder Folge der Grunderkrankung ist, war die FMT in der Regel nicht nur sicher, sondern reduzierte effektiv Beschwerden im unteren GI-Trakt und veränderte die Komposition des Darmmikrobioms nach 16 Wochen signifikant positiv im Sinne einer größeren Artenvielfalt und Diversität. (7)
Quellen:
- N Engl J Med 2019; 380(26): 2518-2528
- Ann Rheum Dis 2019; 78(Suppl2): 75 (OP0017)
- Ann Rheum Dis 2019; 78(Suppl2): 831-832 (FRI0301)
- Ann Rheum Dis 2019; 78(Suppl2): 200-201 (OP0243)
- Ann Rheum Dis 2019; 78(Suppl2): 202 (OP0245)
- Ann Rheum Dis 2019; 78(Suppl2): 167 (OP0183)
- Ann Rheum Dis 2019; 78(Suppl2): 246-247 (OP0327)