Eine interstitielle Lungenerkrankung (ILD), welche nach einer entzündlichen, „alveolitischen“ Phase meist langsam progredient in eine Fibrosierung übergeht, ist bei der diffusen Form der SSc der Hauptrisikofaktor für eine erhöhte Mortalität. Aufgrund der fließenden Übergänge von entzündlichen zu irreversiblen Lungengerüstveränderungen sind Aktivität und Prognose sowie das Ansprechen auf eine antiinflammatorische Therapie schlecht abzuschätzen.
Eine erste prospektive Studie aus dem Jahre 2006 zur Therapie einer frühen bzw. floriden ILD bei SSc, die Scleroderma Lung Study I, konnte eine zwar schwache, aber messbare durchschnittliche Verbesserung der Lungenfunktionsparameter durch Cyclophosphamid (CYC) aufzeigen, insbesondere gegenüber der Verschlechterung aufgrund des natürlichen Progresses einer (unbehandelten) Lungenbeteiligung bei SSc-ILD. (1) Aufgrund der Toxizität von CYC wurde die Therapie aber auf ein Jahr begrenzt und so ging dieser Effekt ohne Fortbehandlung nach ca. 2 Jahren meist wieder verloren. (2) 2016 wurde dann die Scleroderma Lung Study II, eine zweite prospektive, verblindet-randomisierte Studie vorgestellt, welche die Wirkung von Mycophenolat Mofetil (MMF; 3 g/Tag) über 2 Jahre im Vergleich zu oralem CYC (2 mg/kg/Tag) über ein Jahr auf Patienten mit SSc-ILD untersuchte. (3) Unter MMF war der Effekt auf die ILD vergleichbar der von CYC mit einer leichten durchschnittlichen Besserung der forcierten Vitalkapazität (FVC) über 2 Jahre, MMF wurde aber besser vertragen und zeigte eine deutlich geringere Toxizität, sodass seitdem MMF zunehmend und gegenüber CYC bevorzugt zur Behandlung der SSc-ILD eingesetzt wird. Prospektive Daten zum naheliegenden Einsatz von CYC als Induktionstherapie und dann MMF als Erhaltungstherapie fehlen aber leider nach wie vor bei der SSc.
Nintedanib bei SSC-ILD
Nintedanib ist ein Tyrosinkinase-Inhibitor, welcher sowohl Rezeptoren des Vascular Endothelial Growth Factor (VEGF), als auch des Fibroblasten-Wachstumsfaktors (FGF) hemmt und somit sowohl eine antitumoröse (Anti-Angiogenese) als auch eine antifibrotische Wirkung (Fibroblasten-Suppression) aufweist. In Kombination mit Docetaxel ist Nintedanib zur Behandlung des nicht-kleinzelligen Bronchialkarzinoms zugelassen und in Monotherapie bei der idiopathischen Lungenfibrose (IPF).
Oliver Distler, Zürich, stellte auf dem EULAR erstmals die weltweite, randomisierte, doppelblinde, placebokontrollierte SENSCIS-Studie zum Einsatz von Nintedanib bei der ILD im Rahmen einer SSc vor, wobei Ende Juni 2019 die Vollpublikation im New England Journal of Medicine erschienen ist. (4) Insgesamt wurden 819 Patienten (aus 32 Ländern) zwischen November 2015 und Oktober 2017 gescreent. Ein- und Ausschlusskriterien waren u. A. ein Mindestalter 18 Jahre, Diagnose einer SSc mit einer Krankheitsdauer (erstes nicht-Raynaud-Symptom) von max. 7 Jahren mit Nachweis einer ILD mittels HRCT (Fibrose ≥10 %), wobei die FVC nur bis auf max. 40 % des Solls eingeschränkt sein durfte und die Diffusionskapazität (DLCOHb) zwischen 30 und 89 % liegen musste. Dies diente dazu, einerseits eindeutige Fälle einer ILD zu erfassen, andererseits aber auch keine zu weit fortgeschrittenen Krankheitsbilder, die einer antifibrotischen Therapie wahrscheinlich nicht mehr zugänglich sein dürften. Als Hintergrundmedikation war Prednison in einer Dosis von max. 10 mg/Tag erlaubt und MMF oder Methotrexat (MTX), wobei diese für ≥6 Monate stabil gewesen sein musste. Außerdem war eine behandlungsbedürftige pulmonal-arterielle Hypertonie ein Ausschlusskriterium.
Der primäre Endpunkt der Phase-III-Studie war die jährliche Abnahme der FVC (ml/Jahr) über 52 Wochen. Sekundäre Endpunkte waren die absolute Veränderung des modifizierten Rodnan-Skin-Score (mRSS) und als Patient Reported Outcome (PRO) Ergebnisse eines speziellen Fragebogens zur respiratorischen Situation der Patienten (St. George's Respiratory Questionnaire). 239 der 819 Patienten waren sog. „Screening-Failures“, sodass 580 Patienten randomisiert und letztendlich 576 SSc-ILD-Patienten behandelt wurden. Die Therapie wurde – aus unterschiedlichen Gründen – etwas häufiger unter Nintedanib vorzeitig beendet als unter Placebo (jeweils + Standardtherapie, SOC), sodass letztendlich 264 bzw. 275 Patienten bis zur 52. Woche in der Studie verblieben. Die Patientencharakteristika der beiden Behandlungsgruppen zu Baseline waren gut ausgewogen.
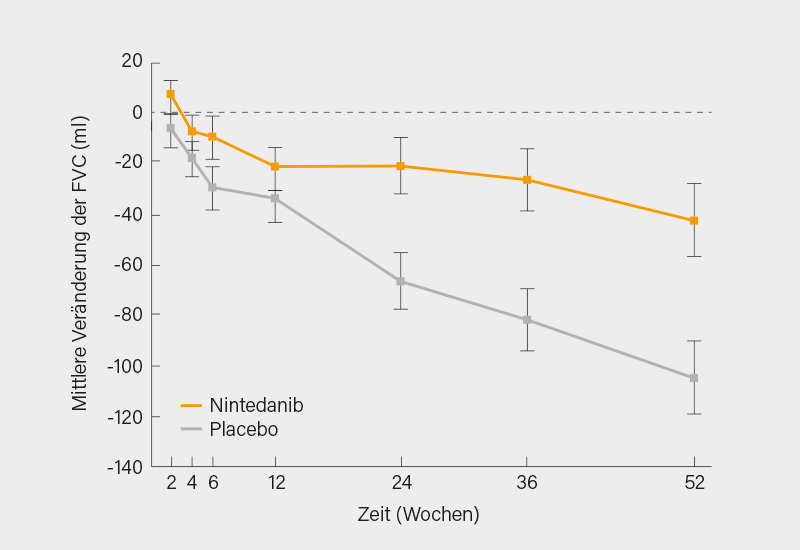
Die adjustierte jährliche Veränderung der FVC war nach 52 Wochen in der Nintedanib-Gruppe mit -52,4 ml/Jahr signifikant niedriger als in der Placebogruppe mit -93,3 ml/Jahr (p=0,04; 95% KI 2,9-79,0), wobei sich dieser Effekt ab der ca. 12. Behandlungswoche abzeichnete (Abb. 1).
Einen absoluten Rückgang der FVC (Woche 52 vs. Baseline) um mehr als 5 %-Punkte wiesen 20,6 % der Patienten unter Nintedanib und 28,5 % unter Placebo (Odds ratio, OR 0,65; 95% KI 0,44-0,96) auf und um mehr als 10 %-Punkte 16,7 % gegenüber 18,1 % (OR 0,91; 95% KI 0,59-1,41). Bei SSc-Patienten, die MMF einnahmen, lag die jährliche Veränderung der FVC bei -40,2 ml unter Nintedanib und bei -66,5 ml unter Placebo, bei Patienten ohne MMF waren dies -63,9 ml unter Nintedanib und -119,3 ml unter Placebo. Eine signifikante Veränderung des mittleren mRSS war in den 52 Wochen der Studie nicht zu verzeichnen (-2,17 Punkte unter Nintedanib und -1,96 Punkte unter Placebo, 95% KI; -0,94 bis 0,53) und auch in den PROs zeigten sich keine Unterschiede.
Die Rate unerwünschter Wirkungen (UEs) war zwar insgesamt ähnlich, solche die zum Therapieabbruch führten, waren aber mit 16 % unter Nintedanib häufiger als unter Placebo mit 9 %. Dabei waren gastrointestinale Nebenwirkungen, wie schon aus den Zulassungsstudien zur IPF bekannt, am häufigsten: 76 % berichteten über Diarrhöen, welche bei 26 % der Patienten zu einer Dosisreduktion von Nintedanib führten und bei 9,2 % zum Therapieabbruch. Insgesamt sind 19 Patienten während der Studie verstorben, 10 (3,5 %) in der Nintedanib- und 9 (3,1 %) in der Placebo-Gruppe.
Fazit: Es handelt sich um eine große, randomisierte, doppelblinde Phase-III-Studie bei SSc mit einer prognostisch relevanten Organmanifestation (ILD), die ihren primären Endpunkt erreicht hat: SSc-Patienten wiesen unter Nintedanib (+ SOC) über 52 Wochen eine signifikant geringere Abnahme der FVC auf als unter Placebo (+ SOC). Ein klinischer Nutzen von Nintedanib im Hinblick auf die sekundären Endpunkte, wie Hautsklerose (mRSS) oder PROs war indes nicht zu verzeichnen. Unerwünschte Ereignisse waren unter Nintedanib ähnlich wie bei IPF mit vor allem gastrointestinalen Nebenwirkungen. Die klinische Relevanz der geringeren FVC-Abnahme unter Nintedanib gegenüber Placebo von (je nach Hintergrundmedikation) um 40-60 ml pro Jahr bei einem Ausgangsvolumen von ca. 2.500 ml bleibt fraglich, wobei berücksichtigt werden muss, dass die mittleren Unterschiede ohne jedwede Therapie (also auch ohne MMF) fast doppelt so hoch waren und sich dieser Effekt natürlich in den Folgejahren noch fortsetzen kann. Dies spricht auf der anderen Seite aber auch wieder dafür, dass MMF bei der SSc-ILD wirksam ist. Man kann eine synergistische, antiinflammatorische Wirkung durch MMF und antifbrotische Wirkung durch Nintedanib annehmen. Für die Beurteilung einer Wirkung auf die Haut dürfte die Studie zu kurz gewesen sein. Hinsichtlich dieser Fragen muss man sicher auch Daten der laufenden (offenen) Long-Term-Extension-Studie abwarten.
Im Hinblick auf eine (zu erwartende?) Zulassung ist auf der einen Seite die Quantifizierung des Zusatznutzens offen, insbesondere auch angesichts der fehlenden PROs und die Frage, inwieweit eine off-label Ko-Medikation mit MMF (oder auch MTX) Teil einer Zulassung sein kann (wenn man die ca. 50 % der Patienten herausrechnen muss, die MMF erhielten, könnte das Ergebnis wiederum seine Signifikanz verlieren). In den USA wurde auf jeden Fall ein beschleunigtes Zulassungsverfahren („Fast Track“) für Nintedanib bei SSc-ILD in Aussicht gestellt.
Tocilizumab bei der SSc?
In diesem Zusammenhang muss auch nochmal auf zwei Studien zum Einsatz von Tocilizumab bei der SSc eingegangen werden, wozu auch auf dem EULAR weitere Auswertungen präsentiert wurden. (5) In einer ersten Phase-II-Studie zum Einsatz von Tocilizumab bei SSc mit 87 Patienten (6) war der primäre Endpunkt einer Verbesserung der Hautsklerose (mRSS) in Woche 24 numerisch, aber nicht statistisch signifikant besser (p=0,09) mit -3,92 gegenüber -1,22 Punkten unter Placebo. Im sekundären Endpunkt eines geringeren Anteils von Patienten mit einer Verschlechterung der FVC war dies aber sehr wohl der Fall (p=0,037). Leider wurde in der nachfolgenden Phase-III-Studie focuSSced (5) mit Tocilizumab (162 mg s.c./Woche gegenüber Placebo über 48 Wochen) erneut die Hautsklerose mit dem mRSS als primärer Endpunkt gewählt und nicht eine Verbesserung einer ILD (nach der die Patienten aber auch nicht selektioniert wurden). Es wurden 212 Patienten randomisiert und 210 behandelt. 81 % waren weiblich, das Durchschnittsalter lag bei 48 Jahren, die Krankheitsdauer bei 23 Monaten. Der mRSS lag im Mittel bei 20,4 Punkten, die FVC bei 82 % des Soll und die DLCO bei 75,6 %.
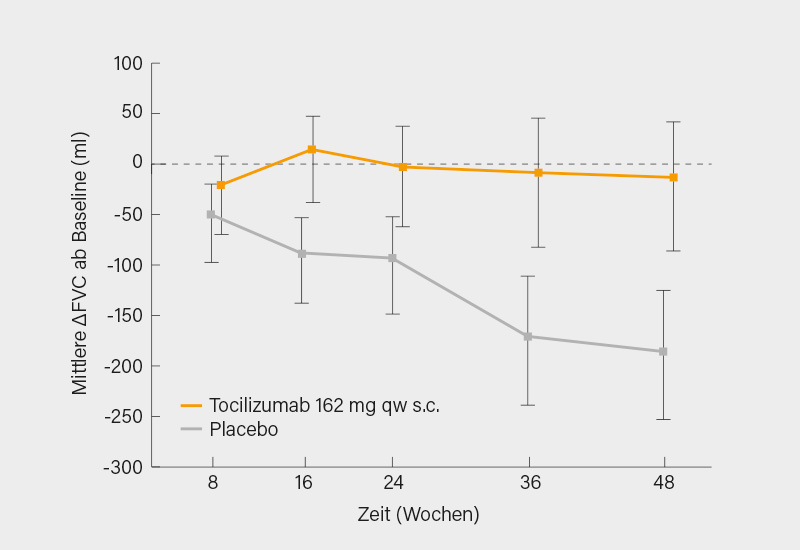
Eine Verbesserung im mRSS war nach 48 Wochen auch schon in der Placebo-Gruppe mit -4,41 Punkten unerwartet hoch, sodass eine vergleichsweise deutliche Veränderung des mRSS in der Tocilizumab-Gruppe mit -6,14 Punkten statistisch nicht mehr signifikant unterschiedlich war (p=0,098) und somit der primäre Endpunkt der Studie auch verfehlt wurde. Die FVC-Veränderung war nach 48 Wochen aber deutlich unterschiedlich mit -3,9 % unter Placebo und -0,6 % unter Tocilizumab, was einer Differenz von durchschnittlich 167 (95% KI 83-250) ml entsprach (Abb. 2). Fünf (5,4 %) Patienten wiesen unter Tocilizumab einen absoluten Rückgang der FVC um ≥10 %-Punkte auf, gegenüber 15 (16,5 %) unter Placebo und auch im HRCT zeigte sich unter Tocilizumab eine geringere Progression.
Fazit: Hätte man in dieser Studie die FVC als primären Endpunkt gewählt, wäre sie erfolgreich gewesen und im (allerdings indirekten) Vergleich mit der SENSCIS-Studie zu Nintedanib war der Unterschied zwischen Verum und Placebo für Tocilizumab sogar deutlicher (bei vergleichbarer Placebo-Response). Leider gibt es zur focuSSced-Studie, die erstmals schon auf dem letzten ACR-Meeting vorgestellt wurde, aber noch keine Vollpublikation.
Systemischer Lupus: Wie häufig ist eine ILD?
Die Daten zu Substanzen mit positiven Effekten auf eine ILD bei der SSc lassen die Frage aufkommen, wie häufig eine solche Lungenbeteiligung bei anderen Kollagenosen vorkommt. Bekannt ist ein ganz ähnliches Bild in Art, Häufigkeit und Prognose einer ILD bei der Dermatomyositis bzw. den Anti-Synthetase-Syndromen. Beim SLE finden sich sehr viel seltener interstitielle Lungenveränderungen. Dies hat eine spanische Arbeitsgruppe jetzt auch auf dem EULAR bestätigt. (7) Von den 165 analysierten SLE-Patienten (im Mittel 37 Jahre, 93 % weiblich), wiesen lediglich 38 (irgendeine) Lungenmanifestationen auf, worunter z. T. auch noch infektiologische Komplikationen subsummiert wurden. Eine ILD war aber mit 1,2 % sehr selten beim SLE.
Niedrig dosierte Prednisolon-Dauertherapie beim SLE?
Während bislang meist eine niedrig dosierte Therapie mit Glukokortikoiden (GK) beim SLE toleriert wurde, wird zur gänzlichen Vermeidung hierdurch bedingter Langzeitschäden auch ein Verzicht auf niedrige Dosen gefordert. In den aktuellen EULAR-Recommendations zur Behandlung des SLE von 2019 wird empfohlen, in der dauerhaften Erhaltungstherapie GK auf max. 7,5 mg/Tag (Prednisonäquivalent) zu minimieren und – wenn möglich – ganz abzusetzen. Eine französische Arbeitsgruppe hat untersucht, inwieweit dies möglich ist. (8) In der prospektiven, randomisierten, offenen, aber kontrollierten CORTICOLUP-Studie wurden von Januar 2014 bis März 2017 SLE-Patienten mit seit mindestens einem Jahr inaktiver Erkrankung (SLEDAI-2K ≤4, BILAG 2004 ≥C in allen Domänen und PGA=0) und stabiler Therapie einschließlich 5 mg Prednison täglich 1:1 randomisiert, entweder weiter 5 mg Prednison zu nehmen oder dieses abzusetzen. Primärer Endpunkt war die Anzahl der Patienten mit Schüben während der folgenden 12 Monate. Bei 124 Patienten (61 in der Erhaltungs- und 63 in der Entzugsgruppe) bestanden bezüglich der Krankheits-Charakteristika keine signifikanten Unterschiede zu Studienbeginn, bis auf einen gewissen Unterschied in der Remissionsdauer von 56 zu 67 Monaten. Im Verlauf waren in dieser monozentrischen Studie keine Drop-outs zu verzeichnen.
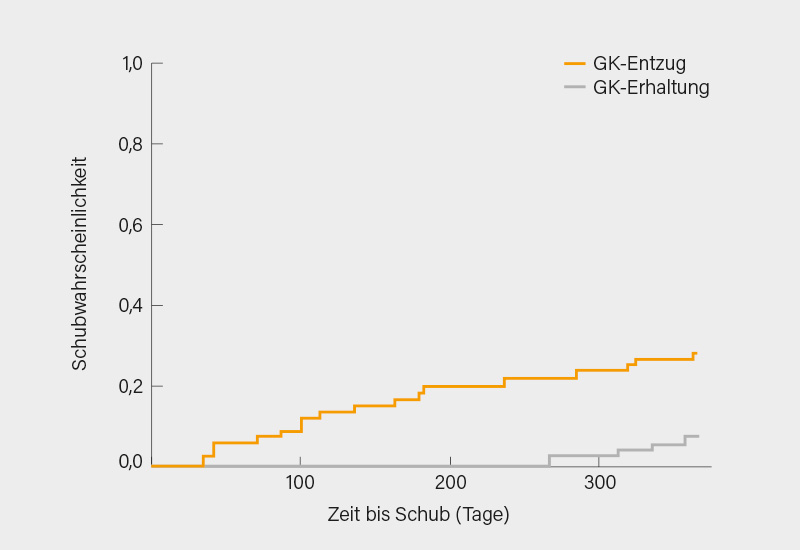
In der Gruppe, welche das Prednison abgesetzt hatte, war es zwar zu signifikant mehr Schüben gekommen (17 vs. 4; p=0,0034) (Abb. 3), diese waren aber in der Mehrzahl leicht oder moderat (12 vs. 3; p=0,029) und schwere Schübe waren nicht signifikant unterschiedlich (5 vs. 1; p=0,208). Die meisten Schübe (>66 %) traten innerhalb der ersten 6 Monate nach Absetzen der niedrig-dosierten GK auf. Es fand sich in der Absetzgruppe kein Zusammenhang zwischen Schüben und Alter, Geschlecht, Krankheitsdauer, Dauer der Remission, der GK-Behandlung, der Gabe begleitender Immunsuppressiva oder der serologischen Aktivität zu Baseline. Bei vier Patienten in der Absetz- und keinem in der Erhaltungsgruppe kam es zu krankheitsbedingten Schäden (Damage): 2 osteoporotische Frakturen, 1 HCQ-Retinopathie, 1 Katarakt.
Fazit: Die Autoren kommen zu dem Schluss, dass das Absetzen niedrig-dosierter GK (Prednison 5 mg/Tag) bei Patienten mit inaktivem SLE und stabiler Therapie für mehr als ein Jahr mit einem hohen Schubrisiko verbunden sei. Man muss aber bedenken, dass die Schubrate insgesamt niedrig war (nur jeder 5. Patient nach dem Absetzen der GK und jeder 20. mit Fortführung der GK) und wenn eher leichte und moderate Schübe innerhalb des 1. Halbjahres nach dem Absetzen auftraten. Wirklich schwere Schübe waren mit 5/61 vs. 1/63 sehr selten. Andersherum betrachtet, würde man 4 von 5 Patienten die Möglichkeit einer Steroidfreiheit vorenthalten, ohne dass sie Gefahr liefen, einen Schub zu entwickeln. Die Daten zum Damage sind nach nur einem (weiteren) Jahr sicher nicht auf das Absetzen oder Fortführen der zuvor über Jahre hinweg gegebenen GK zurückzuführen.
Häufigkeit einer HCQ-Retinopathie
Die Angaben zur Häufigkeit einer Hydroxychloroquin (HCQ)-Retinopathie schwanken deutlich. Die Rate nimmt mit Dauer und Dosis zwar zu, eine besondere Rolle scheint aber auch die nach Körpergewicht normierte Tagesdosis zu spielen, welche zuletzt von max. 6 auf 5 mg pro kg Körpergewicht (KG) reduziert wurde. Die Raten von Netzhautveränderungen unter Antimalariamitteln divergieren dabei umso mehr, je länger die Therapiedauer ist. So fanden sich in einer US-Versicherungsstudie Angaben von bis zu 40 % nach 20-jähriger Einnahme. (9)
Auf dem EULAR-Kongress wurde nun die Analyse einer großen prospektiven US-Lupuskohorte aus Baltimore zur HCQ-Retinopathie vorgestellt. (10) SLE-Patienten werden dort (durchschnittlich) alle 3 Monate gesehen und augenärztliche Kontrollen werden einmal jährlich empfohlen. Je nach Krankenversicherung kommen dort mit der optischen Kohärenztomografie (OCT), dem Elektroretinogramm (ERG), der Microperimetrie (MP) und der Fundus-Autofluoreszenz (FAF) bis zu 4 ophthalmologische Untersuchungen zur Anwendung, wovon die OCT am häufigsten durchgeführt wurde und auch die beste diagnostische „Performance“ mit einer Sensitivität von 93 % und Spezifität von 84 % aufwies.
Die Häufigkeit der Retinopathie nahm zwar auch hier mit den Jahren der HCQ-Therapie zu, war aber bis zuletzt in dieser prospektiven Kohorte weitaus niedriger (~10 % nach 20 Jahren) als in der zuvor genannten retrospektiven US-Versicherungsdatenbank (mit bis zu 40 % nach 20 Jahren). Wenn man dann noch bedenkt, dass diese Rate wahrscheinlich noch geringer wird bei strikter Einhaltung der neuen Dosierungsempfehlung von ≤5 mg HCQ pro kg und Tag, ist eine HCQ-Retinopathie sehr selten und muss auch dann noch nicht einmal zu Visusstörungen führen.
Fazit: Die OCT scheint der optimale Screening-Test zu sein, diese Untersuchung gehört in Deutschland aber nicht zu den Kassenleistungen. Die Autoren weisen auch auf die Notwendigkeit einer entsprechenden Expertise beim Ophthalmologen für die Interpretation der Testverfahren hin, da diese auch häufig abnormal sein können, ohne dass eine HCQ-Retinopathie vorliegt. Ein Absetzen von HCQ auf der Grundlage eines abnormalen Tests ohne Bestätigung durch einen „Retinopathie-Experten“ könnte ein unnötiges Absetzen eines für Lupus-Patienten wichtigen Medikamentes zur Folge haben. Dem kann man sich nur anschließen.
Neue Therapien für den SLE
Es wurden weiterhin keine „bahnbrechenden“ neuen Therapien beim SLE vorgestellt. Über die Versuche mit Baricitinib, Ustekinumab und mit der Sequenztherapie von Rituximab und Belimumab wurde an dieser Stelle schon öfter berichtet. Hierzu wurden keine (wesentlichen) neuen Daten vorgestellt. Es bleiben weiterhin erfolgreiche Phase-III-Studien (die im Gange sind) abzuwarten.
Prof. Dr. med. Christof Specker
Klinik für Rheumatologie & Klinische Immunologie,
Evangelisches Krankenhaus Essen-Werden
Evang. Huyssenstiftung
Pattbergstraße 1-3, 45239 Essen
Literatur:
- N Engl J Med. 2006; 354(25): 2655-2666
- Arthritis Rheumatol 2017; 69(7): 1451-1460
- Lancet Respir Med 2016; 4(9): 708-719
- N Engl J Med 2019; 380(26): 2518-2528
- Ann Rheum Dis 2019; 78(Suppl2): 202 (OP0245)
- Lancet 2016; 387(10038): 2630-2640
- Ann Rheum Dis 2019; 78(Suppl2): 399 (THU0244)
- Ann Rheum Dis 2019; 78(Suppl2): 92 (OP0043)
- JAMA Ophthalmol 2014; 132(12): 1453–1460
- Ann Rheum Dis 2019; 78(Suppl2): 765-766 (FRI0182)