In der Studie wurden Patienten mit moderat bis schwer aktiver RA trotz Methotrexat (MTX)-Therapie im Verhältnis 2:1 auf i.v. ABBV-3373 100 mg für 12 Wochen, gefolgt von Placebo für 12 Wochen (n=31), oder (hoch dosiertes) s.c. Adalimumab 80 mg alle 2 Wochen für 24 Wochen randomisiert (n=17), mit der letzten Dosis in Woche 10 bzw. 22. Bei Patienten auf stabiler Glukokortikoid (GK)-Dosis ≤7,5 mg/Tag) zu Baseline musste dieses bis Woche 4 ganz ausgeschlichen werden. Primärer Endpunkt war die Verbesserung im DAS28-CRP bis Woche 12. Präspezifizierte Vergleiche erfolgten zudem gegen historische Adalimumab 80 mg-Daten alleine und kombiniert mit den aktuell erhobenen Studiendaten. Sekundäre Endpunkte waren die Veränderungen im CDAI, SDAI und DAS28-ESR bis Woche 12, sowie (in Woche 12) ein DAS28-CRP ≤3,2 und das ACR50-Ansprechen. Therapieassoziierte unerwünschte Ereignisse (TAUE) wurden bis Woche 24 erfasst. 96 bzw. 85 % der Teilnehmer schlossen die 12-wöchige aktiv-kontrollierte- bzw. 24-wöchige doppelblinde Extensionsphase ab.
Positive Phase-II-Daten für Anti-TNF/GRM-Konjugat
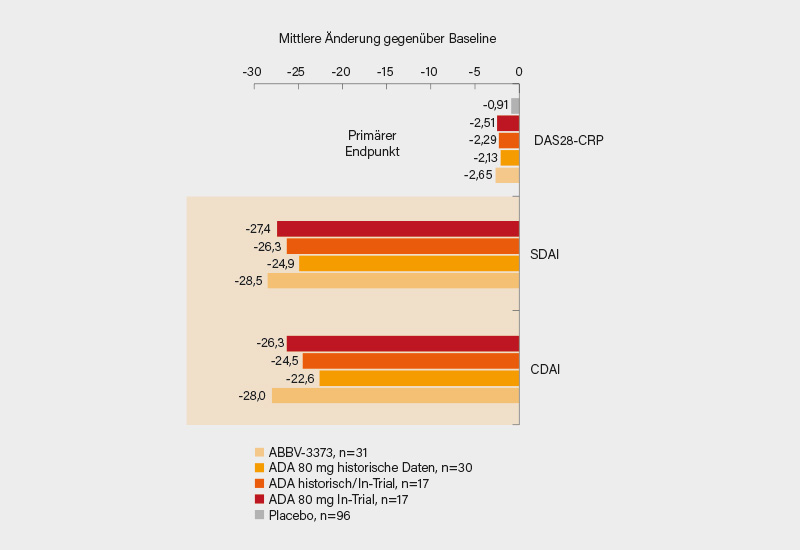
Im Ergebnis bot das Antikörper-Konjugat bei vergleichbarer Ausgangssituation (Demografie, Krankheitscharakteristika) eine signifikante Verbesserung im mittleren DAS28-CRP in Woche 12 gegenüber der prä-spezifizierten historischen Adalimumab-Kohorte (-2,65 vs. -2,13; p=0,022) und schnitt auch besser als der kombinierte und historische Adalimumab-Arm ab (-2,65 vs. -2,29; Wahrscheinlichkeit 89,9 %) (Abb.), numerisch zeigte sich auch ein Vorteil gegenüber dem alleinigen In-Trial-Adalimumab (-2,51). Beide Therapiearme (ABBV-3373 und In-Trial-Adalimumab) waren der synthetischen Placebogruppe signifikant überlegen (-0,91; p<0,001).
Für die sekundären Endpunkte zeigte sich eine größere Effektivität von ABBV-3373 im Vergleich zur historischen Adalimumab-Kohorte; mit einer prädizierten Wahrscheinlichkeit von 79,3-99,5 % traf dies für den Vergleich mit der kombinierten In-Trial- und historischen Adalimumab-Kohorte zu. Fast 55 % der Teilnehmer erreichten unter ABBV-373 in Woche 12 einen DAS28-CRP ≤3,2, dieser blieb bei 70 % bis Woche 24 (trotz Wechsel auf Placebo) erhalten. Die Sicherheitsprofile von ABBV-373 und In-Trial-Adalimumab waren vergleichbar, TAUE traten unter dem ADC bis Woche 12 seltener auf (35,5 vs. 70,6 %). Es gab 2 schwere Infektionen unter ABBV-3373 und keine unter In-Trial-Adalimumab. Auch kam es zu einem anaphylaktischen Schock unter ABBV-3373, woraufhin die Dauer der i.v.-Applikation von 3 auf 15-30 min. gesteigert wurde. Es gab keine negativen Effekte auf die HPA-Achse, zu achten sein wird auf die Bildung von Anti-Drug-Antikörpern.
Die Daten dieser Pilotstudie geben durchaus Anlass zur Hoffnung auf eine potenziell bessere Effektivität des neuen Antikörper-Konjugats gegenüber der alleinigen Anti-TNF-Therapie – auch gibt es Anhaltspunkte, dass (kaum Wirkverlust zwischen Woche 12 und 24) eine zeitliche Streckung der Applikation möglich sein könnte. Erst eine Phase-IIb- (oder Phase-III)-Studie wird hier weiteren Aufschluss geben. Inzwischen wurde zudem ein leicht modifiziertes Anti-TNF/GRM-ADC (ABBV-154) entwickelt, dass eine s.c.-Applikation ermöglicht, und bei RA, Polymyalgia rheumatica und Morbus Crohn evaluiert wird.
Quelle: Arthritis Rheumatol 2022; doi: 10.1002/art.42415