Gänzlich neu sind die als Late-breaking Abstract von Mark C. Genovese, Palo Alto (USA), präsentierten Daten einer randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie zum Einsatz des selektiven JAK-1-Inhibitors Upadacitinib bei Patienten mit aktiver RA und unzureichendem Ansprechen auf oder Intoleranz gegen Biologika (bDMARDs). In der Studie wurden Patienten mit aktiver RA (TJC/SJC ≥6; hsCRP ≥3 mg/l) auf stabiler Therapie mit csDMARDs im Verhältnis 2:2:1:1 auf Upadacitinib 15 oder 30 mg 1x tgl. oder Placebo für 12 Wochen gefolgt von Upadacitinib 15 oder 30 mg 1x tgl. für alle Patienten ab Woche 12. Von initial 498 Patienten (mittlere Krankheitsdauer 13 Jahre, DAS28-CRP 5,8, TJC68 27,9, SJC66 16,8, 53 % ≥2 bDMARDs) schlossen 451 (90,6 %) und 419 (84,1 %) die 12- bzw. 24-Wochen-Phase ab. Primäre Endpunkte waren die Anteile von Patienten mit einem ACR20-Ansprechen und DAS28-CRP ≤3,2 in Woche 12 (Non-Responder-Imputation, NRI).
Upadacitinib effektiv bei Biologika-refraktärer RA
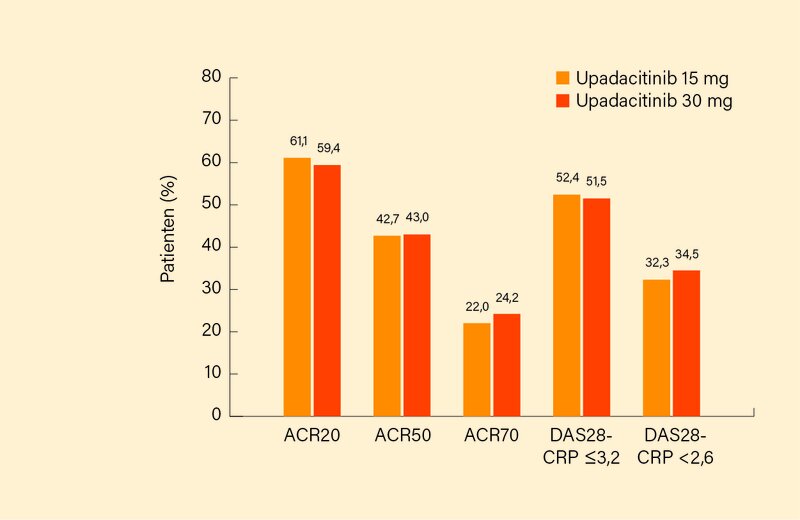
Im Ergebnis erreichten in Woche 12 signifikant mehr Patienten auf Upadacitinib 15 oder 30 mg versus Placebo die primären Endpunkte, so ein ACR20-Ansprechen mit 64,6 und 56,4 vs. 28,4 % und einen DAS28-CRP ≤3,2 mit 43,3 und 42,4 vs. 14,2 % (je p<0,001). Gleiches galt auch für sekundäre Endpunkte wie das ACR50/70-Ansprechen oder eine DAS28-CRP-Remission <2,6, die unter der höheren Upadacitinib-Dosierung 35,8, 23,0 und 23,6 % der zuvor schwer therapierefraktären Patienten erreichten (je p<0,001). Eine signifikante Besserung zeigte sich auch im HAQ-DI (-0,39 und -0,42 vs -0,17; p<0,001). Bereits in Woche 1 war im ACR20 ein signifikanter Vorteile beider Upadacitinib-Dosierungen erkennbar (27,4 und 24,8 vs. 10,7 %; p<0,001). In Woche 24 war das Ansprechen der durchgehend mit Upadacitinib behandelten Patienten ähnlich oder höher (ACR20/50/70 ca. 60/43/23 %, DAS28-CRP ≤3,2 bzw. <2,6 ca. 52/33 %; Abb.) als zu Woche 12 und vergleichbar bei Patienten, die erst in Woche 12 auf den JAK-1-Inhibitor wechselten. Das Sicherheitsprofil entsprach jenem der beiden Phase-II-Studien mit einer jeweils etwas höheren Rate unerwünschter Ereignisse (UE) einschließlich schwerer Infektionen und Herpes zoster sowie vorzeitiger Drop-outs unter Upadacitinib 30 mg. Eine gewisse Aufmerksamkeit verdienen 2 bzw. 4 Fälle einer tiefen Venenthrombose (TVT) bzw. Lungenembolie (LE) (jedoch keine Dosisabhängigkeit, alle Patienten mit TVT/LE-Risikofaktoren), die in anderen Phase-II/III-Studien aber nicht gesehen wurden.
Somit führte Upadacitinib ohne klaren Dosisbezug bei diesen auch gegenüber Biologika therapierefraktären RA-Patienten zu einer raschen (Woche 1) und signifikanten Besserung der Krankheitsaktivität in Woche 12 und 24 bei zugleich akzeptablem Sicherheitsprofil. Eine genaue Bewertung des Nutzen-Risiko-Profils wird nach Abschluss des Phase-III-Programms möglich sein, jedoch scheint die 15 mg-Dosierung bei fast identischer Effektivität hier leichte Vorteile zu bieten. (1)
Hohe Effektivität nach Versagen auf csDMARDs
Nur eine Woche nach dem EULAR-Kongress waren als Pressemitteilung erste positive Ergebnisse einer randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie zu Upadacitinib bei Patienten mit aktiver RA und unzureichendem Ansprechen auf csDMARDs vermeldet worden. Details hierzu wurden stellvertretend für die internationale Studiengruppe in San Diego von Gerd R. Burmester, Berlin, vorgestellt. In der ersten kontrollierten Studienphase wurden die Patienten im Verhältnis 1:1:1 entweder auf Upadacitinib 1x 15 oder 30 mg/Tag oder Placebo für 12 Wochen randomisiert. Von den 661 eingeschlossenen Teilnehmern schlossen 618 (93,5 %) die Studienphase ab. Als primäre Wirksamkeits-Endpunkte waren auch hier das ACR20-Ansprechen und ein DAS28-CRP ≤3,2 in Woche 12 (NRI) festgelegt worden.
Alle primären und sekundären Endpunkte wurden mit beiden Upadacitinib-Dosierungen signifikant erreicht (je p<0,001). Bezüglich der primären Outcome-Parameter erzielten unter Upadacitinib 15 und 30 mg gegenüber Placebo 63,8 und 66,2 vs. 35,7 % ein ACR20-Ansprechen und 48,4 und 47,9 vs. 17,2 % eine niedrige Krankheitsaktivität gemäß DAS28-CRP in Woche 12. Auch in dieser Studie fiel ein sehr früher Wirkeintritt auf, mit einer statistischen Signifikanz im ACR20 bereits in Woche 1 (22,2 und 28,3 vs. 8,6 %). Auch beim Anlegen strengerer Kriterien wie dem ACR50/70 zeigte sich in Woche 12 eine signifikante Überlegenheit von Upadacitinib 15 mg (38,0 bzw. 20,8 %) und 30 mg (43,4 bzw. 26,5 %) versus Placebo (14,9 bzw. 5,9 %). Dies galt auch für das Erreichen einer DAS28-CRP-Remission <2,6 (30,8 und 28,3 vs. 10,0 %), einer Verbesserung im HAQ-DI sowie in Bezug auf Morgensteifigkeit und Fatigue (FACIT-F).Wie zu erwarten war die Rate aller und schwere UE unter Upadacitinib numerisch höher als unter Placebo, jedoch entsprachen diese früheren Phase-II-Studien und vor allem schwere Ereignisse waren sehr selten und hier ohne erkennbare Dosisabhängigkeit. (2)
In der Gesamtschau zeigten sowohl Upadacitinib 15 als auch 30 mg in diesem Kollektiv von auf csDMARDs versagenden Patienten eine gute und rasche Wirksamkeit, insbesondere mit Blick auf strengere Kriterien wie den ACR70 und die DAS28-Remission. In dieser Studie scheint (bis Woche 12) die höhere Dosis etwas effektiver zu sein; hier bleiben Langzeitdaten abzuwarten, nachdem sich die Effekte in der eingangs beschriebenen Phase-III-Studie bei Biologika-erfahrenen Patienten bereits in Woche 24 stark angeglichen hatten. Auffällig war das hier gute Sicherheits- und Verträglichkeitsprofil, das sicherlich auch das in dieser Studie untersuchte Patientenkollektiv (kürzere Krankheitsdauer, Biologika-naiv) widerspiegelt.
Somit befindet sich Upadacitinib auf einem guten Weg in Richtung Zulassung bei RA, zumal auch die gleichfalls in San Diego vorgestellten Langzeitdaten aus BALANCE-EXTEND, einer offenen Verlängerung der Phase-II-Studien, nach einer durchschnittlichen Upadacitinib-Exposition von 525 Tagen (kumulative Exposition ~725 Patientenjahre) keine neuen Sicherheitssignale aufzeigten. (3)
Quellen:
- ACR-Kongress 2017; Late-breaking Abstract 10L
- Arthritis Rheumatol 2017; 69(S10): Abstr. 1904
- Arthritis Rheumatol 2017; 69(S10): Abstr. 509