In fünf „Overarching Principles“ wird festgehalten, dass SLE ein multidisziplinäres, individualisiertes Management (inkl. Shared Decisison Making und Patientenschulung) erfordert, die Krankheitsaktivität bei jeder klinischen Visite mit validierten Scores erfasst werden sollte (Untersuchung auf Organschäden mindestens 1x jährlich), dass zur Verbesserung des Langzeitoutcomes nicht-pharmakologische Interventionen (Sonnenschutz, Rauchstopp, gesunde/ausgewogene Ernährung, körperliche Aktivität, Knochengesundheit) wichtig sind und dass pharmakologische Interventionen an Patientencharakteristika, der Art und Schwere der Organbeteiligung, Therapierisiken, Komorbiditäten, dem Risiko für progressive Organschäden und der Patientenpräferenz auszurichten sind. Last but not least sind eine frühen SLE-Diagnose (inkl. Serologie), regelmäßiges Screening (Organbeteiligung, v. a. Nephritis), sofortiger Begin einer am Ziel Remission (oder niedrigen Krankheitsaktivität) ausgerichteten Therapie und strikte Therapieadhärenz essenziell für die Prävention von Schüben und Organschäden, die Verbesserung der Prognose sowie der Lebensqualität.
Weniger Glukokortikoide, Biologika aufgewertet, neu: Anifrolumab
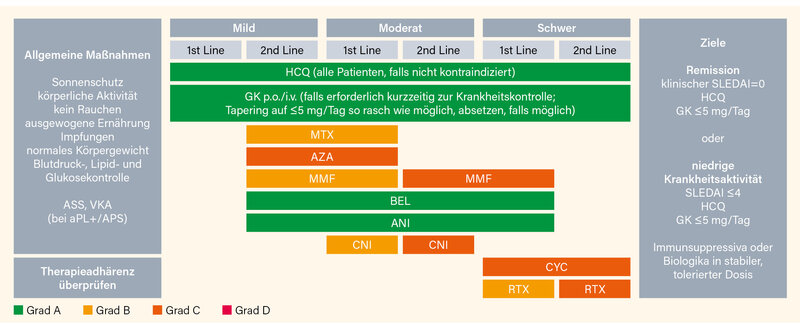
Insgesamt werden „nur“ 13 Empfehlungen ausgesprochen: 1) Hydroxychloroquin (HCQ) wird, falls nicht kontraindiziert, für alle Patienten empfohlen (1b/A) mit einer Zieldosis von 5 mg/kg Körpergewicht/Tag (2b/B), mit individueller Anpassung gemäß dem Risiko für Schübe (2b/B) und retinale Toxizität. 2) Glukokortikoide (GK), wenn erforderlich, werden dosiert gemäß Art und Schwere der Organbeteiligung (2b/C) und sollten auf eine Erhaltungsdosis von ≤5 mg/Tag reduziert (2a/B), und, falls möglich, abgesetzt werden. Bei mäßig bis schwer erkrankten Patienten können i.v. Methyprednisolon (MP)-Pulse (125-1.000 mg/Tag für 1-3 Tage) erwogen werden (3b/C). 3) Bei Patienten, die auf HCQ nicht ansprechen (allein oder in Kombination mit GK), oder GK nicht in den akzeptablen Bereich reduzieren können, sollten immunsuppressive/-modulierende Medikamente wie Methotrexat (MTX, 1b/B), Azathioprin (AZA, 2b/C) oder Mycophenolat Mofetil (MMF, 2a/B) und/oder bDMARDs (Belimumab [BEL], Anifrolumab [ANI]; jeweils 1a/A) erwogen werden (Abb. 1).
4) Bei Patienten mit organ- oder lebensbedrohender Erkrankung sollte i.v. Cyclophosphamid (CYC, 2b/C) erwogen werden, in refraktären Fällen kann Rituximab (RTX, 2bC) erwogen werden. 5) Die Therapie einer aktiven Hauterkrankung sollte Topika (GK, Calcineurin-Inhibitoren [CNI]) (2b/B), Antimalariamittel (HCQ, CQ) (1a/A), und/oder falls erforderlich systemische GK (4/C) beinhalten, in der Zweitline Anifrolumab (1a/A), Belimumab (1a/B), MTX (1b/B) oder MMF (4/C). 6) Beim aktiven neuropsychiatrischen SLE sollten GK und Immunsuppressiva für entzündliche Manifestationen (1b/A) und Plättchenhemmer bzw. Antikoagulanzien für atherothrombotische/Antiphopholipid (aPL)-assoziierte Manifestationen (2b/C) erwogen werden. 7) Zur Akuttherapie der schweren autoimmunen Thrombozytopenie sollten hochdosierte GK (inkl. i.v.-MP-Pulse) (4/C) mit oder ohne i.v. Immunglobulin G (4/C) und/oder RTX (2b/B) und/oder hochdosiertes i.v. CYC (4/C), gefolgt von einer Erhaltung mit RTX (2b/B), AZA (2b/C), MMF (2b/C) oder Ciclosporin (4/C) erwogen werden.
Lupusnephritis: Belimumab und Voclosporin sind neu dabei
8) Patienten mit aktiver proliferativer LN sollten niedrigdosiertes (EuroLupus) i.v. CYC (1a/A) oder MMF (1a/A) und GK (i.v. MP-Pulse, gefolgt von niedriger dosierten oralen GK) erhalten; eine Kombinationstherapie mit Belimumab (entweder mit CYC oder MMF) (1b/A) oder CNI (vor allem Voclosporin [VOC] oder Tacrolimus [TAC], kombiniert mit MMF) (1a/b) sollte erwogen werden (Abb. 2). 9) Nach einem renalen Ansprechen sollte die Therapie der LN mindestens 3 Jahre andauern (2b/B); initial mit MMF allein oder in Kombination mit Belimumab oder einem CNI behandelte Patienten sollten auf diesen Medikamenten bleiben (1a/A), während MMF oder AZA bei jenen, die initial CYC allein (1a/A) oder in Kombination mit Belimumab (1a/A) erhielten, CYC ersetzen sollten. 10) Bei Patienten mit hohem Risiko für Nierenversagen (definiert als reduzierte GFR, histologischer Nachweis einer granulären Halbmondbildung als Zeichen einer rasch-progressiven Glomerulonephritis oder fibrinoide Nekrose oder schwere interstitielle Entzündung) kann hochdosiertes (NIH-Regime) i.v. CYC (1a/A) in Kombination mit i.v. MP-Pulsen in Betracht gezogen werden.
11) Bei SLE-Patienten, die eine anhaltende Remission erreichen, kann ein graduelles Tapering erwogen werden, beginnend mit dem Entzug von GK (2a/B). Es wird aber darauf hingewiesen, dass bei LN besondere Vorsicht angebracht ist, erste Versuche sollten erst nach 3-5 Jahren Therapie mit IS/bDMARDs unternommen werden. 12) SLE assoziiert mit Antiphospholipidsyndrom (APS) sollte nach einem ersten arteriellen oder unprovozierten venösen thrombotischen Ereignis langfristig mit Vitamin K-Antagonisten (VKA) gemanagt werden (1b/B); niedrigdosiertes ASS (75-100 mg/Tag) sollte bei SLE/non-APS-Patienten mit Hochrisiko-aPL-Profil erwogen werden (2a/B). Es wird auf mögliche antithrombotische Effekte von HCQ hingewiesen, direkte orale Antikoagulanzien (DOAK) sind zu vermeiden. 13) Immunisierungen zur Prävention von Infektionen (HZV, HPV, Influenza, COVID-19, Pneumokokken), ein Management der Knochengesundheit, Nieren- und kardiovaskulärer Schutz sowie Screening auf Malignitäten sollten durchgeführt werden (5/D).
Wichtige Neuerungen im Überblick
Steroide wirken bei SLE gut, sind aber mit exzessiven Kollateralschäden verbunden und daher besser g als Rescue- bzw. Bridging-Therapie geeignet, bei längerem Einsatz sollte die Dosis 5 mg/Tag (nicht wie zuvor 7,5) nicht übersteigen. Die höchsten Empfehlungsgrade erhalten die beiden bDMARDs Belimumab und (neu) Anifrolumab, die ohne Umweg direkt nach HCQ (also ohne vorherige Immunsuppressiva) gegeben werden können; primäres Ziel ist die frühe Reduktion des Steroidbedarfs! Zwar werden die bDMARDs bei Patienten mit aktiven Hauterkrankung nur in der Zweitlinie empfohlen, gerade für Anifrolumab ist hier künftig noch mit einer Aufwertung zu rechnen. Bei schwerem SLE dürften künftig noch andere Optionen wie die Kombination aus CYC und RTX sowie verstärkt die CAR-T-Zell-Therapie diskutiert werden. Bei LN sind die wichtigsten Veränderungen seit 2019 (LN-Empfehlungen), dass nicht zwischen Klasse III/IV und V unterschieden wird, und Belimumab oder CNI (vor allem Voclosporin) bei allen LN-Patienten als Add-on-Therapie erwogen werden sollten. Es gibt keine klare Präferenz für Belimumab oder Voclosporin, ersteres hat potenziell Vorteile in puncto Sicherheit, Schubprävention, bei nicht zu schwerer Proteinurie und bei extrarenalem Lupus, letzteres in Bezug auf höhere Remissionsraten und Steroideinsparung, vor allem bei schwerer Proteinurie sind rasche Effekte zu erwarten. Für die Renoprotektion sind auch die SGLT2-Inhibitoren zu diskutieren, für eine breitere Berücksichtigung es fehlt aber derzeit noch an Evidenz aus Studien.
Quelle: Ann Rheum Dis 2023; doi: 10.1136/ard-2023-224762