Bei IgG4-RD, die diverse Organe in Mitleidenschaft zieht und zu irreversiblen Organschäden führen kann, werden in der Regel Glukokortikoide (GK) gegeben, die aber selbst auf Dauer zu Komplikationen beitragen. In die an 80 Zentren in 22 Ländern durchgeführte MITIGATE-Studie wurden 135 erwachsene Patienten (im Mittel 58,2 Jahre, Krankheitsdauer 2,6 Jahre) mit aktiver IgG4-RD (mit Score ≥20 die ACR/EULAR-Klassifikationskriterien für IgG4-RD erfüllend) und multipler Organbeteiligung (>80 % mit ≥3 betroffenen Organen) trotz GK-Therapie eingeschlossen und nach ihrem Status (neu diagnostiziert vs. rezidivierende Erkrankung; 46 vs. 54 %) stratifiziert.
Die Teilnehmer wurden im Verhältnis 1:1 auf i.v. 300 mg Inebilizumab (n=68, 43 % Frauen) oder Placebo (n=67, 27 % Frauen) an Tag 1, 15 und Woche 26 (nach Prämedikation) randomisiert (die Prednison-Dosis betrug initial 20 mg/Tag, danach erfolgte ein Tapering bis zum Absetzen am Ende der 8. Studienwoche). Die randomisiert-kontrollierte Studienphase dauerte bis Woche 52. Primärer Endpunkt war die Zeit bis zum ersten IgG4-RD-Schub, definiert als neue/sich verschlechternde Zeichen und Symptome der IgG4-RD-Aktivität, die eines oder mehrere der für die Studie neu entwickelten organspezifischen Flare-Kriterien erfüllten, drei wichtige sekundären Endpunkte waren die jährliche Schubrate, eine schub- und behandlungsfreie komplette Remission und eine schub- und steroidfreie komplette Remission.
Häufigere Remissionsraten, geringerer Steroidbedarf
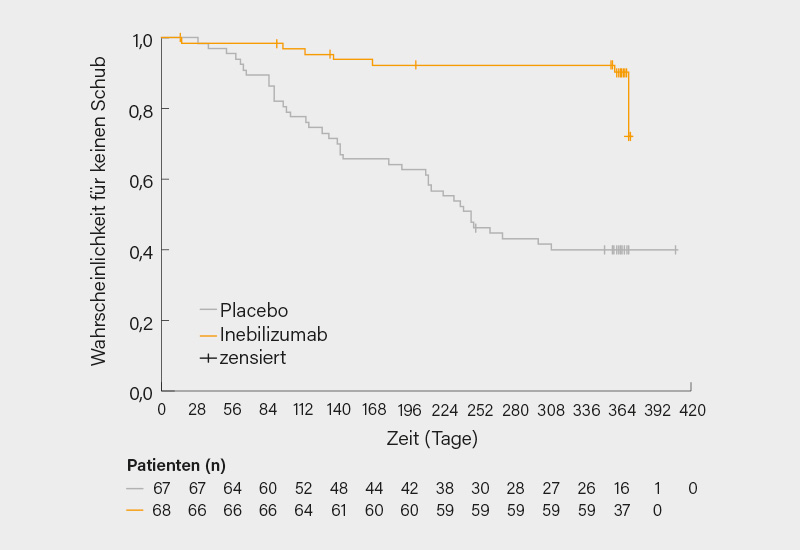
Der primäre Endpunkt wurde mit Inebilizumab signifikant erreicht mit einer Reduktion des Risikos für IgG4-RD-Schübe bis Woche 52 gegenüber Placebo um 87 % (10 vs. 60 %; Hazard Ratio 0,13, 95% KI 0,06-0,28; p<0,0001) (Abb.). Auch alle wichtigen sekundären Endpunkte wurden nach 52 Wochen signifikant erreicht, so bei der jährlichen Schubrate (0,10 vs. 0,71, Rate Ratio, RR 0,14, 95% KI 0,06-0,31; p<0,0001), schub- und therapiefreien kompletten Remission (57,4 vs. 22,4 %, Odds Ratio, OR 4,68, 95% KI 2,21-9,91; p<0,0001) und schub- und steroidfreien kompletten Remission (58,8 vs. 22,4 %, OR 4,96, 95% KI 2,34-10,52; p<0,0001) – letzteres zugleich die Möglichkeit einer Steroideinsparung anzeigend. Während der randomisiert-kontrollierten Studienphase kam es bei 97,1 % der Patienten unter Inebilizumab und 98,5 % unter Placebo zu ≥1 therapieassoziierten unerwünschten Ereignis (TEAE), dabei handelte es sich am häufigsten (≥10 %) um COVID-19 (23,5 vs. 19,4 %), Lymphopenie (16,2 vs. 9,0 %) und Harnwegsinfektionen (11,8 vs. 6,0 %). Schwere (vor allem COVID-19, Appendizitis und Divertikulitis) und/oder opportunistische Infektionen (primär Herpes Zoster) waren unter Inebilizumab häufiger als unter Placebo (8,8 vs. 3,0 %), Todesfälle gab es keine. Es wurden insgesamt keine neuen Sicherheitssignale identifiziert, das Sicherheitsprofil war identisch mit jenem aus früheren Studien.
Als Fazit bleibt, dass mit der MITIGATE-Studie, der ersten randomisierten, doppelblinden, placebokontrollierten Studie in dieser Indikation, die Effektivität und Sicherheit der CD19-gerichteten B-Zell-Depletion mit Inebilizumab bei IgG4-RD etabliert werden konnte. Von einer künftigen Zulassung – auch das wäre die erste in dieser Indikation – ist mit großer Sicherheit auszugehen.
Quelle: N Engl J Med 2024; doi: 10.1056/NEJMoa2409712