Auch dem IL-12/23-Signalweg wird eine Rolle in der komplexen Pathogenese des SLE zugeschrieben. Die Effektivität und Sicherheit des u .a. bereits für Psoriasis vulgaris und die Psoriasis-Arthritis zugelassenen IL-12/23-Hemmers Ustekinumab bei Patienten mit aktivem SLE untersuchte nun eine internationale Studiengruppe unter der Leitung von Ronald van Vollenhoven, Amsterdam (Niederlande), in einer als Late-breaking Abstract präsentierten randomisierten, placebokontrollierten Phase-II-Studie. Hierin eingeschlossen waren 102 erwachsene Patienten (91 % Frauen, mittleres Alter 41 Jahre, SLEDAI-2K im Mittel 10,9) mit seropositivem SLE (ANA, Anti-dsDNA und/oder Anti-Smith-Antikörper) gemäß den SLICC-Kriterien und aktiver Erkrankung (SLEDAI-Score ≥6 und ≥1 BILAG A- und/oder ≥2 BILAG B-Scores) trotz einer Standardtherapie (SoC). Im Verhältnis 3:2 erfolgte eine Randomisierung auf Ustekinumab i.v. 6 mg/kg oder Placebo in Woche 0, gefolgt von Ustekinumab s.c. 90 mg alle 8 Wochen oder Placebo (jeweils plus SoC). Als primärer Endpunkt wurde der Anteil von Patienten mit SLE Responder Index (SRI)-4-Ansprechen in Woche 24 erfasst. Wichtige sekundäre Endpunkte in Woche 24 waren die Veränderung ab Baseline im SLEDAI-2K, ärztlichen Globalurteil (PhGA) und der Anteil von Patienten mit BICLA-Ansprechen.
Ustekinumab punktet in Phase-II
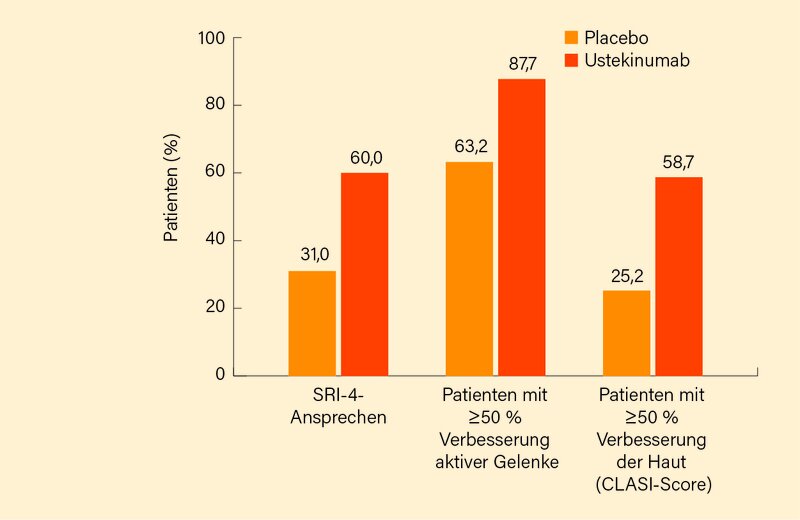
In Woche 24 erreichten mit 60 % unter Ustekinumab im Vergleich zu 31 % unter Placebo signifikant mehr Patienten ein SRI-4-Ansprechen (p=0,0046) (Abb.). Bereits ab Woche 12 war ein vorteilhafter Therapieeffekt des IL-12/23-Inhibitors ersichtlich. Die mit Ustekinumab behandelten Patienten zeigten überdies von Woche 0 bis 24 versus Placebo eine größere mediane Veränderung im SLEDAI-2K (-6,0 vs. -2,0; p=0,0265) und PhGA (-2,5 vs. -1,6, p=n.s.). Kein Unterschied war beim BICLA-Ansprechen in Woche 24 auszumachen (35,0 vs. 33,3 %; p=n.s.), obwohl unter den BICLA-Non-Respondern ein signifikant größerer Anteil der Ustekinumab-Patienten keine BILAG-Verschlechterung aufwies (74,4 vs. 39,2 %; p=0,0043). Das Risiko für einen neuen BILAG-Flare (≥1 neuer BILAG A oder ≥2 neue BILAG B) war im Ustekinumab-Arm signifikant geringer als in der Placebo-Gruppe (Hazard ratio, HR 0,11; p=0,0078). Zusätzlich demonstrierte Ustekinumab eine gegenüber Placebo signifikant stärkere Verbesserung muskuloskelettaler und mukokutaner SLE-Manifestationen (p=0,02 bzw. 0,04) (Abb.). Anti-dsDNA- und C3-Spiegel zeigten sich ebenfalls deutlich verbessert. Zugleich bestätigte sich das aus anderen Indikationen bekannte Sicherheitsprofil von Ustekinumab mit (schweren) unerwünschten Wirkungen ungefähr auf Placeboniveau.
In der Gesamtschau zeigte sich somit nach 24 Wochen eine oftmals signifikante Besserung klinischer und serologischer SLE-Parameter unter Ustekinumab, das künftig eine effektive Therapieoption mit neuartigem Wirkmechanismus bei SLE darstellen könnte. Das Potenzial des Antikörpers in noch klarer definierten Patientengruppen muss aber zunächst noch in Phase-II bzw. III-Studien unter Beweis gestellt werden. (1)
Blisibimod: Enttäuschte Hoffnungen
Kurz dargestellt seien an dieser Stelle noch die von US-amerikanischen Rheumatologen um Joan T. Merrill, Oklahoma City, vorgestellten Daten der randomisierten, placebokontrollierten Phase-III-Studie CHABLIS-SC1 zu dem in Phase-II-Studien noch mit vielversprechenden Ergebnissen aufwartenden selektiven BAFF-Inhibitor Blisibimod. Nach den zuvor negativen Erfahrungen aus anderen Phase-III-Studien war hier bereits darauf geachtet worden, vor allem Patienten mit höherer Krankheitsaktivität, hohem Steroidverbrauch sowie hoher Anti-dsDNA-Aktivität und niedrigem Komplementspiegel einzuschließen.
Randomisiert wurden 442 SLE-Patienten auf Steroidtherapie (≤0,5 mg/kg oder 40 mg; im Mittel 15,6 mg), ANA und/oder Anti-dsDNA positiv und einem SELENA-SLEDAI-Score ≥10 (im Mittel 13,5) unter SoC auf wöchentlich s.c. Blisibimod 200 mg oder Placebo. Renale SLE-Patienten waren nicht ausgeschlossen, wenn die Proteinurie nicht 6 g/24 h überstieg oder eine Eskalation der immunsuppressiven Therapie erforderlich war. Ab Woche 8 wurde ein Steroidtapering bis auf ≤7,5 mg Prednison/Tag verfolgt. Primärer Endpunkt war in Woche 52 ein SRI-6-Ansprechen (≥6-Punkt Besserung im SELENA-SLEDAI, kein neuer BILAG 1A oder 2B-Schub, <0,3-Punkt-Anstieg im PhGA) ohne neuen/Dosis-gesteigerten Immunsuppressiva oder Antimalariamitteln.
Der primäre Endpunkt SRI-6 in Woche 52 wurde verfehlt (ca. 48 vs. 42 %), auch aufgrund einer unerwartet hohen Placebo-Ansprechrate. Mehr Blisibimod-behandelte Teilnehmer erreichten eine Prednison-Dosis ≤7,5 mg/Tag in den Wochen 40-52, auch zeigte sich ein Vorteil im sekundären Endpunkt, der zusätzlich zum SRI-6-Kriterium in Woche 52 eine niedrigere Steroiddosis in Woche 40-52 versus Baseline verlangte (24 vs. 14 %; p=0,056). Teils signifikante Reduktionen wurden in Bezug auf Anti-dsDNA, periphere B-Zell-Linien, APL-Antikörper und Immunglobuline erreicht, der C3/C4-Spiegel stieg signifikant an. In einer Subgruppe von 135 Patienten mit Protein/Kreatinin-Ratio (PCR) im Urin ≥0,5 mg/mg zu Baseline fand sich eine deutlichere PCR-Abnahme im Blisibimod-Arm und in Woche 52 erreichten signifikant mehr Patienten eine >50 % Reduktion der PCR ab Studienbeginn (59,7 vs. 30,8 %; p=0,006) und/oder PCR <0,5 (53,2 vs. 30,8 %; p=0,02). Die Verträglichkeit war überaus gut mit (abgesehen von Reaktionen an der Einstichstelle) nur milden bis mäßigen Nebenwirkungen auf Placeboniveau. Trotz positiver Effekte in puncto Steroidreduktion und renaler Funktion bleibt festzuhalten, dass Blisibimod aufgrund des klar verfehlten primären Endpunkts keine Zukunft in der SLE-Therapie hat. (2)
Quellen:
- ACR-Kongress 2017; Late-breaking Abstract 6L
- Arthritis Rheumatol 2017; 69(S10): Abstr. 888
Ausblick
Auf einem guten Weg sind derweil die gemeinsam von ACR und EULAR entwickelten neuen Klassifikationskriterien für SLE mit einem ANA-Antikörpertiter ≥1:80 als Eingangskriterium. Deren Grundzüge, verschiedenen klinischen und immunologischen Domänen (einschließlich gewichteter Subdomänen), die – zusätzlich zum ANA-Kriterium – bei Erreichen eines auf ≥10 festgelegten Schwellenwerts eine Klassifikation als SLE erlauben, wurden von SLE-Experten auf einem Symposium in San Diego diskutiert. Die EULAR war dort durch Prof. Dr. Martin Aringer, Dresden, vertreten. Mit der Präsentation des finalen, validierten Kriterienkatalogs seitens der beiden Fachgesellschaften ist laut Prof. Dr. Sindhu Johnson, Toronto (Kanada), auf dem EULAR-Kongress 2018 in Amsterdam zu rechnen.