In der zunächst veröffentlichten 12-wöchigen, doppelblinden, placebokontrollierten Phase-IIa-Dosiseskalationsstudie mit 42 Patienten mit aktivem SLE wurden Iberdomid-Dosierungen von 0,3 mg alle 2 Tage oder täglich, alternierend 0,3 und 0,6 mg/Tag und 0,6 mg/Tag getestet. Es wurde eine akzeptable Sicherheit mit meist milden unerwünschten Ereignissen (UE) nachgewiesen und eine Wirksamkeit aller Dosierungen in Bezug auf das globale Arzturteil (PGA) und das Cutaneous Lupus Erythematosus Disease Area and Severity Index (CLASI)-Ansprechen. (1)
Mit hoher Dosis signifikante Vorteile im SRI-4-Ansprechen
In der nachfolgenden Phase-IIb-Studie wurden 288 Patienten ≥18 Jahre mit Autoantikörper-positivem SLE und einem SLEDAI 2K-Score ≥6 (im Mittel 9,6) im Verhältnis 2:2:1:2 für 24 Wochen zusätzlich zu einer Standardtherapie auf orales Iberdomid in Dosierungen von 1x 0,45, 0,3 bzw. 0,15 mg/Tag oder Placebo randomisiert. In Woche 24 wurden die Placebo-Patienten auf Iberdomid 0,3 und 0,45 mg re-randomisiert. Es erfolgte eine Stratifizierung nach dem SLEDAI-2K (≥10/<10) und der Prednison-Dosis (≥10/<10 mg/Tag; max. 20 mg/Tag). Ein Steroidtapering war erlaubt von Woche 8-16. Die Gesamtstudiendauer betrug 52 Wochen, primärer Endpunkt war das SRI-4-Ansprechen in Woche 24.
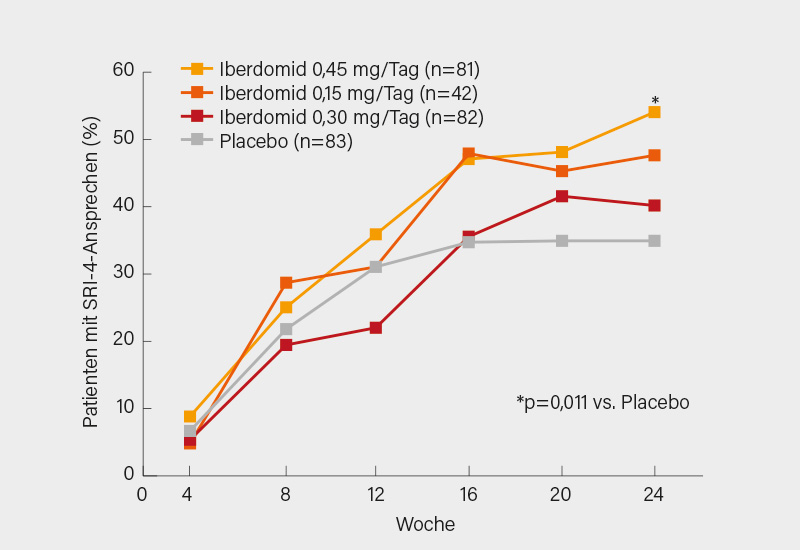
Der primäre SRI-4-Endpunkt in Woche 24 wurde mit Iberdomid 0,45 mg gegenüber Placebo signifikant erreicht (54 vs. 35 %; p=0,01), nur im Trend besser war die SRI-4-Response auf 0,3 und 0,15 mg Iberdomid mit 50 bzw. 48 % (Abb.). Die meisten sekundären Endpunkte (Einzelkomponenten des SRI-4) wurden verfehlt mit Ausnahme einer SLEDAI 2K-Reduktion ≥4 Punkte (mit der höchsten Dosierung 56 vs. 36 %). Patienten mit einem SLEDAI-2K ≥10 zu Baseline erreichten unter Iberdomid 0,45 mg/Tag häufiger ein SRI-4-Ansprechen in Woche 24 (66 vs. 39 %). In der Subgruppe mit hohem Aiolos bzw. Typ-1 Interferon (IFN) betrug es 64 vs. 33 % bzw. 60 vs. 33 %. In Woche 24 war Iberdomid 0,45 mg/Tag auch im Hautansprechen (CLASI 50) bei Patienten mit subakutem (92 vs. 53 %) und chronischem kutanen LE (62 vs. 28 %) überlegen, nicht aber in der Gesamtpopulation.
Die Rate von therapieassoziierten UE war versus Placebo erhöht (40 % unter 0,45 mg/Tag vs. 29 %), immerhin 10 % der Teilnehmer brachen die Studie unter der hohen Iberdomid-Dosierung vorzeitig ab. Am häufigsten waren Harn- und Atemweginfektionen (16 % unter 0,45 mg/Tag vs. 4 %), auch Neutropenie und Leukopenie traten deutlich öfter auf. Damit zeigte Iberdomid 0,45 mg eine vor allem in Subgruppen (hohes Aiolos bzw. Typ-1 IFN) gute Wirksamkeit bei aber nicht ganz einfachem Sicherheitsprofil. (2)
Eine Weiterentwicklung von Iberdomid in Phase-III erscheint durchaus fraglich – zumal seitens des Herstellers eine Priorisierung auf die onkologische Indikation nicht unwahrscheinlich ist, erläuterte Karen Costenbader, Boston (USA), in einem begleitenden Editorial. (3) Somit sollte man angesichts des nicht ganz überzeugenden Nutzen/Risiko-Profils die Hoffnungen nicht zu hoch stecken, trotz der Hinweise auf ein gutes Ansprechen in bestimmten Subgruppen.
Quellen:
1 Lupus Sci Med 2022; 9(1): e000581
2 N Engl J Med 2022; 386(11): 1034-1045
3 N Engl J Med 2022; 386(11): 1085-1086