Das neu entwickelte Fusionsprotein blockiert als CD40L-Antagonist kostimulatorische Signale zwischen B- und T- und antigenpräsentierenden Zellen und scheint so ein breites Spektrum zellulärer und humoraler Antworten, welche die Autoimmunität beim SjS antreiben, zu unterdrücken. Dass der CD40/CD40L-Signalweg tatsächlich eine wichtige Rolle in der Pathogenese des SjS spielt, wurde jetzt in der ALISS-Studie mit ihrem Crossover-Design in zwei distinkten Patientenpopulationen untermauert.
Gutes Ansprechen in zwei relevanten Patientengruppen
In der ersten Studie zu Dazodalibep wurden 74 erwachsene SjS-Patienten mit mäßiger bis hoher systemischer Krankheitsaktivität (ESSDAI ≥5) im Verhältnis 1:1 für 24 Wochen auf i.v. Dazodalibep 1.500 mg (n=36) oder Placebo (n=38) zunächst alle 2 Wochen [Q2W] 3 Dosen, dann Q4W 4 zusätzliche Dosen randomisiert (Phase I). Es handelte sich fast durchweg um Frauen, das mittlere Alter betrug 50 Jahre, der mittlere ESSDAI und ESSPRI zu Baseline betrugen 10,7 bzw. 6,6. Ab Tag 169 erfolgte für 16 Wochen ein Crossover (Phase II): Die Dazodalibep-Gruppe erhielt Placebo und die Placebo-Gruppe Dazodalibep (Q4W 5 Dosen), daran schloss sich eine 12-wöchige (therapiefreie) Nachbeobachtung an. 95,9 bzw. 90,9 % der Patienten schlossen Phase I bzw. II ab. Primärer Endpunkt war die Veränderung im ESSDAI zu Tag 169. Dieser wurde mit Dazodalibep signifikant erreicht mit einer Reduktion um -6,3 vs. -4,1 unter Placebo (Δ -2,2; p=0,0167). Im Vergleich zu Placebo zeigten sich nach 24 Wochen positive Trends in Bezug auf den ESSPRI sowie FACIT-Fatigue-Score. In Phase II verbesserte sich in der Placebo/Dazodalibep-Gruppe (n=37) der ΔESSDAI von Baseline von im Mittel -4,1 an Tag 169 auf -6,3 an Tag 365. Im Dazodalibep/Placebo-Arm (n=34) betrug die Veränderung im ESSDAI −6,3 an Tag 169 und fiel dann auf -4,4 an Tag 365.
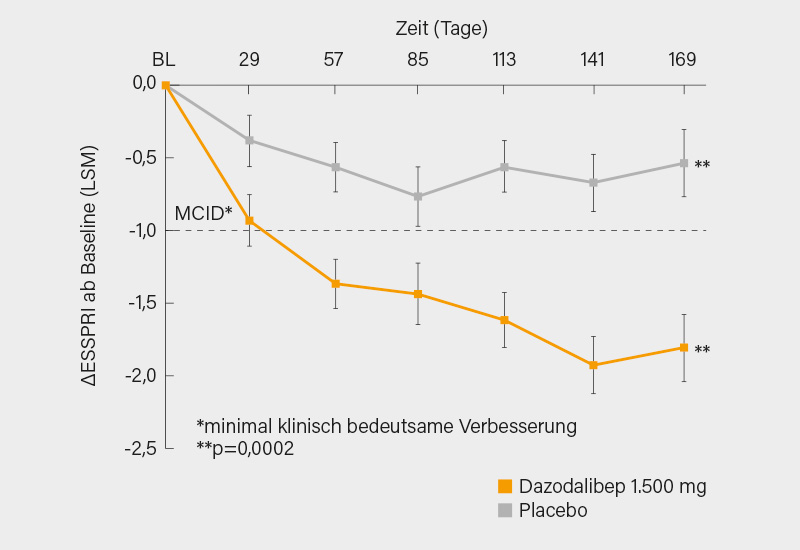
Fast noch interessanter war der zweite Studienteil, der sich mit einer Population mit inakzeptabel hoher Krankheitslast, aber eher geringer systemischer Krankheitsaktivität befasste, die üblicherweise nicht Eingang in klinische Studien findet (94,5 % Frauen, im Mittel 49,9 Jahre). Der Studienaufbau war identisch mit jenem der ersten Studie, hier wurden 109 Patienten im Verhältnis 1:1 auf Dazodalibeb (n=54) oder Placebo (n=55) randomisiert. Bei diesen waren ein ESSPRI ≥5 und ESSDAI <5 (im Mittel 2,8 zu Baseline) gefordert sowie ein stimulierter Speichelfluss ≥0,1 ml/min. und nur eine limitierte extraglanduläre Beteiligung. 93,6 bzw. 86,2 % der Teilnehmer schlossen Phase I bzw. II ab. Primärer Endpunkt war die Veränderung des ESSPRI bis Tag 169. Dieser wurde nach 24 Wochen signifikant erreicht mit einer Reduktion im ESSPRI von -1,80 vs. -0,53 (Δ -1,27; p=0,0002) (Abb.). Es zeigten sich in allen ESSPRI-Domänen gegenüber Placebo signifikant größere Verbesserungen (Trockenheit, p=0,0066; Fatigue, p=0,0022; Schmerz, p=0,0010). Nach dem Crossover verbesserte sich in der Placebo/Dazodalibep-Gruppe der ESSPRI von -0,5 an Tag 169 auf -1,3 an Tag 365. Im Dazodalibep/Placebo-Arm blieb der ESSPRI am Ende von Phase I (Tag 169) bis Tag 365 erhalten (-1,8 bzw. -1,9).
Die Sicherheit und Verträglichkeit von Dazodalibep waren insgesamt gut, als häufigste unerwünschte Ereignisse wurden COVID-19, Diarrhöe, Kopfschmerzen, Nasopharyngitis, Infektionen der oberen Atemwege, Arthralgie, Konstipation und Harnwegsinfekte berichtet. Inzwischen sind zwei Phase-III-Studien zu Dazodalibep bei diesen beiden SjS-Populationen angelaufen.
Quelle: Nat Med 2024; 30(6): 1583-1592