Nach einem Literaturreview und Abstimmungsverfahren verabschiedete die 33-köpfige Task Force aus Erwachsenen- und pädiatrischen Rheumatologen vier „Overarching Principles“ und 14 spezifische Empfehlungen. (A) Es wird betont, dass es sich bei der sJIA und AOSD um dieselbe Erkrankung handelt, und daher einheitlich als Still’s Disease bezeichnet werden soll (unabhängig vom Erkrankungsalter). (B) Die Therapieziele und -strategien sollten auf einem „shared decision making“ zwischen Eltern/Patienten und dem Behandlungsteam basieren. (C) Eine zielorientierte Therapie (Treat-to-target, T2T) durch regelmäßige Bestimmung der Krankheitsaktivität und entsprechende Anpassung der Therapie ist wichtig. Ultimatives Ziel ist die medikamentenfreie Remission. (D) Es wird gefordert, dass ein Makrophagenaktivierungssyndrom (MAS) sofort erkannt und rasch behandelt werden sollte.
Spezifische Empfehlungen im Überblick
Diagnostik: (1) Um eine rasche Diagnose und frühe Therapieeinleitung zu erleichtern, sollten operationale Definitionen genutzt werden, um Patienten mit Still-Syndrom zu identifizieren. Dies betrifft Fieber (meist mit Fieberspitzen ≥39 °C für mindestens 7 Tage), Hautausschlag (transient, parallel zu den Fieberspitzen, primär den Rumpf betreffend, typischerweise erythematös und lachsfarben, aber auch andere Formen sind mit der Diagnose vereinbar), muskuloskelettale Beteiligung (meistens Arthralgie bzw. Myalgie; eine Arthritis stützt die Diagnose, ist aber dafür nicht erforderlich und kann sich auch später entwickeln) und hohe Entzündungsspiegel (typischerweise durch neutrophile Leukozytose, erhöhtes Serum-CRP und Ferritin zu identifizieren) (Evidenzgrad 2a, Empfehlungsstärke B). (2) Eine markante Erhöhung von Interleukin (IL)-18 und/oder S100-Proteinen (z. B. Calprotectin) unterstützt in starkem Maße die Diagnose, diese sollten daher falls möglich bestimmt werden (4, C). (3) Alternative Diagnosen wie Malignitäten, Infektionskrankheiten, andere immunvermittelte entzündliche Erkrankungen und monogenetische autoinflammatorische Erkrankungen sollten sorgfältig in Betracht gezogen werden (5, D).
Ziele und Timing: (4) Eine klinisch inaktive Erkrankung (CID) ist definiert als das Fehlen von mit dem Still-Syndrom assoziierten Symptomen und ein normales ESR oder CRP. Remission ist definiert als eine Phase ≥6 Monate mit CID (5, D). (5) Um das ultimative Ziel zu erreichen (eine medikamentenfreie Remission), werden folgende Zwischenziele empfohlen: An Tag 7 Fieberrückgang und CRP-Reduktion ≥50 %, zu Woche 4 kein Fieber, Reduktion aktiver (geschwollener) Gelenke >50 %, normales CRP und globales Arzt- bzw. Eltern/Patientenurteil <20 auf VAS 0-100), zu Monat 3 CID mit Glukokortikoiden (GK) <0,1 (Erwachsene) bzw. 0,2 mg/kg/Tag (Kinder) und zu Monat 6 eine CID ohne GK (5, D).
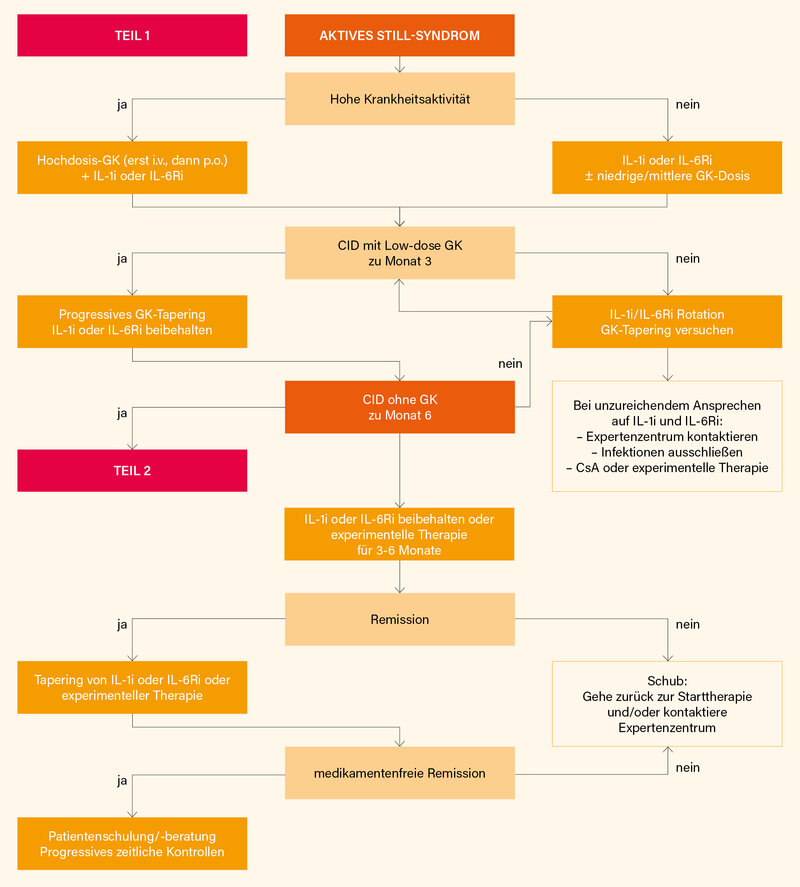
Therapie: (6) Um eine längere Gabe systemischer GK zur Zielerreichung/-erhaltung zu vermeiden, sollten aufgrund hoher Evidenz zu deren Effektivität IL-1- und IL-6-(Rezeptor)-Inhibitoren (IL-6Ri) prioritär eingesetzt werden (1b, A). (7) Ein IL-1i- oder IL-6Ri sollte so früh wie möglich nach Sicherung der Diagnose initiiert werden (2b, B). (8) Die Erhaltung einer CID für 3 bis 6 Monate ohne GK sollte erreicht sein, bevor man mit einem Tapering von bDMARDs beginnt (5, D). Als Vorschlag für das konkrete, stufenweise Vorgehen wurde ein zweistufiger Therapiealgorithmus entwickelt (Abb.).
Komplikationen: (9) Schwere/lebensbedrohliche Komplikationen, einschließlich MAS und Lungenerkrankungen (LD), können sich zu jedem Zeitpunkt im Krankheitsverlauf entwickeln. Patienten sollten aktiv gescreent und überwacht werden (2a, B). (10) Ein MAS sollte in Betracht gezogen werden bei Patienten mit Fieber, Splenomegalie, erhöhtem/ansteigendem Serum-Ferritin, niedrigen Zellzahlen, abnormer Leberfunktion, intravaskulärer Aktivierung von Koagulation und erhöhten/steigenden Serum-Triglyzeriden (2a, B). (11) Die Therapie des MAS muss hochdosierte GK einschließen. Zusätzlich sollten Anakinra, Ciclosporin und/oder Interferon (IFN)g-Inhibitoren als Bestandteil der Initialtherapie in Betracht gezogen werden (2b, B). (12) Auf LD sollte aktiv gescreent werden mit Suche nach klinischen Symptomen (z. B. Clubbing, persistierender Husten, Dyspnoe) und Lungenfunktionstests (Pulsoxymetrie, DLCO-Bestimmung) und bei Patienten mit klinischem Symptomen eine HRCT durchgeführt werden (2b, B). (13) Auf Basis der verfügbaren Daten stellen vorliegende LD-Risikofaktoren oder die Entwicklung einer Still-Syndrom-LD keine Kontraindikation für IL-1i oder IL-6Ri dar (2b, B). (14) Schwer zu behandelnde („difficult-to-treat“) Patienten, solche mit schwerem MAS oder mit LD sollten in Zusammenarbeit mit Still-Syndrom-Expertenzentren gemanagt werden (5, D). (1)
Ein kurzer Exkurs zum refraktären MAS
In diesem Kontext kurz erwähnt seien zwei Fallberichte italienischer Experten um Roberta Caorsi, Genua, zur Therapie von refraktärem, rezidivierendem MAS bei sJIA-Patienten. In beiden Fällen hatten hochdosierte GK, Ciclosporin, Anakinra und/oder andere Biologika (z. B. Eculizumab, Baricitinib; nicht aber IFNg-Inhibitoren) versagt oder nur temporär geholfen. Äußerst erfolgreich war dann der Einsatz des derzeit auch in anderen IL-18-getriebenen Indikationen geprüften bispezifischen IL-1b/IL-18-Antikörpers MAS825, der zur langfristigen Kontrolle des MAS, einer drastischen Steroidreduktion und auch Besserung anderer sJIA-Manifestationen führte. Gerade bei Still-Syndrom-Patienten mit refraktärem, rezidivierendem MAS und hohen IL-18-Serumspiegeln könnte der 2-wöchentlich zu infundierende Antikörper künftig interessant sein, auf eine weitere Prüfung ist zu hoffen. (2)
Quellen:
1 Ann Rheum Dis 2024; 83(12): 1614-1627
2 Rheumatology 2024; doi: 10.1093/rheumatology/keae440