Es kommt nicht völlig überraschend: Vor gut zwei Jahren hatten US-amerikanische Experten bereits in einer Studie gezeigt, dass die Mikrobiota des Darms durchaus eine gewichtige Rolle in der Pathogenese der rheumatoiden Arthritis (RA) spielen könnte. Insgesamt wurden mit Collinsella, Eggerthella und Faecalibacterium drei Bakteriengattungen identifiziert, die bei RA-Patienten gehäuft vorkommen und mit einem Anstieg des proinflammatorischen Zytokins IL-17A assoziiert sind. Für Collinsella-Bakterien zeigte sich danach im Mausmodell, dass diese den Schweregrad der RA erhöhen. Fast parallel veröffentlichte eine US-Arbeitsgruppe Daten, die darauf schließen lassen, dass die Darmmikrobiota im Sinne präventiver Wirkungen bei RA gezielt beeinflusst werden könnte. So konnte im Mausmodell durch eine Fütterung mit dem Bakterium Prevotella histicola die Rate einer neu entstehenden Arthritis vermindert und deren Verlauf abgeschwächt werden. Auch für die Psoriasis-Arthritis und axiale Spondyloarthritis wurden entsprechende spezifische Zusammenhänge berichtet.
Schwächung der Darmbarriere nachgewiesen
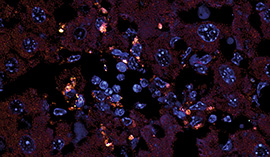
Doch zurück zum SLE: Eine vergleichbare Erkrankung wie der SLE kann bei der „(NZW × BXSB)F 1-Hybrid“-Maus ausgelöst werden. Die zunächst keimfrei aufgewachsenen Tiere erkranken, sobald sie Kontakt mit der Außenwelt aufgenommen haben. Den intensivsten Kontakt mit den Keimen der Außenwelt hat das Immunsystem im Darm, weil es dort jene Darmbakterien bekämpfen muss, die die Schleimhautbarriere überwinden. Die Forscher um Kriegel fanden heraus, dass die Mäuse bei einer Antibiose mit Vancomycin nicht erkrankten. Als Auslöser wurde schließlich das grampositive Enterokokken-Bakterium E. gallinarum (Abb.) ausgemacht, dass sich nicht nur im Darm, sondern auch in Lymphknoten, Leber und Milz fand. Das bewegliche Bakterium kann nicht nur die Schleimhautbarriere überwinden, sondern schwächt auch die Tight-Junctions und Zonula adhaerens, die die Lücken zwischen Darmepithelzellen füllen und in der Regel ein Eindringen von Darmbakterien verhindern. Die Schwächung der Darmbarriere könnte somit zu den auslösenden Faktoren bei SLE zählen.
Dass E. gallinarum in die Pathogenese des SLE-Modells involviert ist, konnte experimentell weiter abgesichert werden. So wurde die Erkrankung ausgelöst, wenn der Darm der Tiere gezielt nur mit E. gallinarum besiedelt wurde, während ein Impfstoff gegen E. gallinarum verhinderte, dass es zu der Autoimmunerkrankung kam. Vermutlich stimulieren die Bakterien in Leberzellen die Bildung von Proteinen, gegen die das Immunsystem Antikörper bildet, die dann die Autoimmunreaktion starten. Erste Hinweise darauf, dass diese Mechanismen auch beim Menschen greifen, lieferte eine Folgeuntersuchung. So fanden sich in Leberbiopsien von SLE-Patienten Genspuren von E. gallinarum, nie jedoch bei gesunden Kontrollen. Eine Infektion humaner Leberzellen mit E. gallinarum führte zur Bildung der gleichen Autoantigene wie im Mausmodell und SLE-Patienten wiesen die gleiche Störung der Darmbarriere auf.
Ausblick: Die experimentelle Studie könnte somit neue Ansätze für die Therapie des SLE aufzeigen. Eine Option wäre es, durch Antibiotika oder eine gezielte Impfung eine systemische Infektion mit E. gallinarum zu unterbinden. Würde dies zur Abschwächung der Autoimmunreaktion und im Idealfall zu einem Abklingen der Symptome führen, wäre dies auch der Nachweis dafür, dass E. gallinarum tatsächlich ein wichtiger Trigger des SLE ist. Wie für andere rheumatologische Indikationen gilt aber, dass angesichts der Komplexität des Mikrobioms der Weg zu konkreten therapeutischen Schritten noch sehr weit ist.
Quelle: Science 2018; 359(6380): 1156-1161