Die Rationale, durch eine sequenzielle Therapie mit Belimumab und Rituximab über eine effektivere B-Zell-Depletion eine bessere Krankheitskontrolle zu erreichen, liegt eigentlich auf der Hand. In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie BLISS-BELIEVE wurde dieses Therapieprinzip nun auf den Prüfstand gestellt. In der 104-wöchigen Studie wurden 263 Patienten (modifizierte ITT-Population) mit aktivem SLE (92 % Frauen, im Mittel 40 Jahre, mittlere Krankheitsdauer 7 Jahre, SLEDAI 2K-Score 10, tägliche Glukokortikoid-Dosis 10 mg) im Verhältnis 1:2:1 auf s.c. Belimumab 200 mg/Woche für 52 Wochen und i.v. Placebo in Woche 4 und 6 (n=72) oder s.c. Belimumab 200 mg/Woche für 52 Wochen und i.v. Rituximab 1.000 mg in Woche 4 und 6 (n=144) (plus Nachbeobachtung bis Woche 104) oder (als Referenz) s.c. Belimumab 200 mg/Woche plus Standardtherapie (SoC) für 104 Wochen randomisiert (n=47). Primärer Endpunkt war die Krankheitskontrolle (SLEDAI-2K ≤2 ohne andere Immunsuppressiva und Prednison[äquivalent]-Dosis von ≤5 mg/Tag) in Woche 52. Der primäre Vergleich erfolgte zwischen Belimumab/Rituximab und Belimumab/Placebo. Wichtige sekundäre Endpunkte waren klinische Remission (klinischer SLEDAI-2K =0, ohne andere Immunsuppressiva und Glukokortikoide) in Woche 64 und die Krankheitskontrolle in Woche 104. Weitere Endpunkte waren z. B. die Dauer der Krankheitskontrolle, Anti-dsDNA-Antikörper, C3/C4, B-Zellen und die Sicherheit.
Nur tendenzielle Vorteile der Sequenztherapie
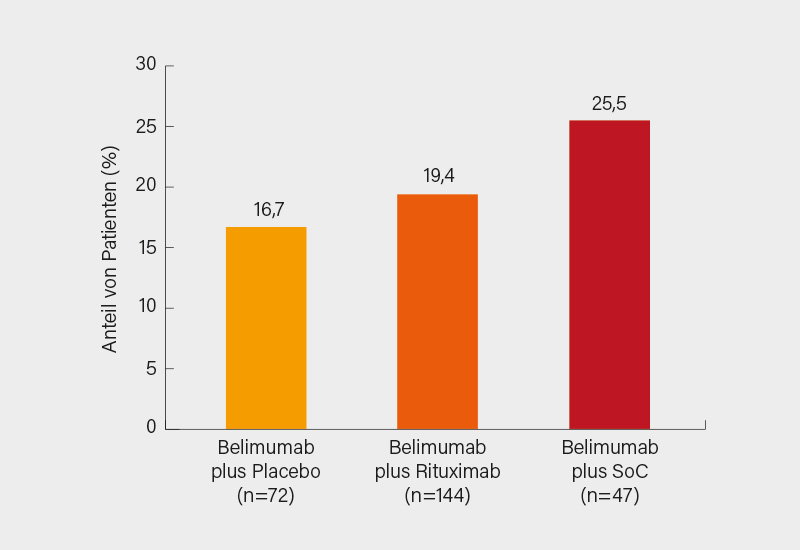
Im Ergebnis erreichten 16,7, 19,4 und 25,5 % der Patienten unter Belimumab/Placebo, Belimumab/Rituximab und Belimumab/SoC den primären Endpunkt Krankheitskontrolle in Woche 52. Für den Vergleich von Belimumab/Placebo mit Belimumab/Rituximab zeigte sich kein signifikanter Unterschied (Odds Ratio, OR 1,27, 95% KI 0,60-2,71; p=0,5342) (Abb.). Die Remissionsrate in Woche 64 war unter Belimumab/Rituximab (6,3 %) etwas höher als im Belimumab/Placebo-Arm (p=n.s.), aber niedriger als unter Belimumab/SoC (10,6 %). Eine Krankheitskontrolle in Woche 104 erreichten 11,1 vs. 6,9 % (p=n.s.), im Belimumab/SoC-Arm waren es immerhin 21,3 %. Signifikant besser schnitt Belimumab/Rituximab nur in Bezug auf die erreichte Dauer der Krankheitskontrolle bis Woche 52 ab (105 vs. 60 Tage; p=0,019), unter Belimumab/SoC waren es 87 Tage. Die Autoren spekulieren, dass womöglich das vor Studienbeginn erfolgte Tapering von Standard-Immunsuppressiva über nur 4 Wochen zu aggressiv war. Besser sehen die Ergebnisse in Bezug auf Biomarker aus: Von zu Baseline Anti-dsDNA-positiven Patienten testeten unter Belimumab/Rituximab 24,3 % zu Woche 52 negativ auf diese, im Belimumab/Placebo-Arm waren es 5,7 % (p=0,019). Auch die B-Zell-Zahlen fielen unter der Kombination stärker ab. Nach Absetzen von Belimumab stiegen die Biomarker aber wieder an. Die Rate von unerwünschten Ereignissen (UE) war vergleichbar, aber zum Abbruch führten sie relativ häufiger unter Belimumab/Rituximab (11,8 %). Auch zeigten sich darunter mehr schwere UE (17,4 %), hauptsächlich schwere Infektionen oder Infestationen.
Als Fazit bleibt somit, dass die Zugabe eines einzelnen Rituximab-Zyklus zu Belimumab lediglich zu einer geringen Verbesserung von Krankheitskontrolle und klinischer Remission führte (bei einem allerdings nicht der üblichen Praxis entsprechenden Studienprotokoll). Im Hinblick auf Nebenwirkungen zeigten sich die bekannten Sicherheitsprofile beider
Therapien.
Quelle: Ann Rheum Dis 2024; doi: 10.1136/ard-2024-225686