Auf der ACR-Jahrestagung 2019 in Atlanta standen tatsächlich eher andere Indikation als die RA im Vordergrund, so vor allem die axiale Spondyloarthritis und Psoriasis-Arthritis sowie der systemische Lupus erythematodes. Im Hinblick auf die RA waren zudem viele hier gezeigte Studiendaten bereits zuvor auf dem EULAR-Kongress präsentiert worden. An dieser Stelle sei zunächst auch auf einige Studien eingegangen, die wohl kaum große Bedeutung für den künftigen Praxisalltag erlangen werden, aber dennoch von Interesse waren.
NORD-STAR-Studie: Viel Aufwand, doch wenig Ertrag?
Eigentlich sollte man annehmen, dass die Frage nach der Ersttherapie – Methotrexat (MTX) plus Glukokortikoid (GK), dann gemäß Treat-to-target-Prinzip bei Bedarf rasche Eskalation auf ein csDMARD oder b/tsDMARD – durch die EULAR- und DGRh-Leitlinie hinreichend geklärt war. Dennoch wurde in skandinavischen Ländern und den Niederlanden die große, von Studienärzten um Merete Lund Hetland, Kopenhagen (Dänemark), initiierte randomisierte, offene Phase-IV NORD-STAR-Studie aufgelegt. 812 Patienten mit einer sehr frühen (<2 Jahre Krankheitsdauer, im Mittel nur 7 Tage nach Diagnose!), aktiven RA (DAS28-CRP >3,2, im Mittel 5,0, SJC/TJC je ≥2, 75 bzw. 82 % RF/ACPA-positiv) wurden darin auf Basis einer MTX-Therapie (bis 25 mg/Woche nach 1 Monat) im Verhältnis 1:1:1:1 auf eine aktive konventionelle Therapie (ACT; entweder 20 mg/Tag Prednisolon [Tapering auf 5 mg binnen 9 Wochen] oder Sulfasalazin 2 g/Tag, Hydroxychloroquin 35 mg/kg/Woche [SSZ/HCQ] und verpflichtenden i.a. Triamcinolon-Injektionen in ≤4 Gelenke [≤80 mg/Visite bis zu Woche 20]), s.c. Certolizumab 200 mg/2 Wochen (400 mg in Woche 0, 2 und 4), s.c. Abatacept 125 mg/Woche oder Tocilizumab (i.v. 8 mg/kg/4 Wochen; s.c. 162 mg/Woche) randomisiert (i.a. Triamcinolon-Injektionen waren bis Woche 20 erlaubt). Primärer Endpunkt war eine CDAI-Remission <2,8 in Woche 24 (ITT-Analyse). In der Per-Protokoll-Population wurde eine 15 %-Marge für Nicht-Unterlegenheit festgelegt.
In der ITT-Analyse erreichten 42,0 % (ACT), 47,8 % (Certolizumab), 52,5 % (Abatacept) und 41,0 % (Tocilizumab) der Patienten den primären Endpunkt einer CDAI-Remission in Woche 24 – bemerkenswert hohe Raten, die sich in ähnlicher Verteilung auch für die sekundären Endpunkte ACR/EULAR Boolean-Remission (31-38 %), DAS28-Remission (63-70 %) und SDAI-Remission (42-52 %) zeigten. Im Ergebnis konnte für die CDAI-Remission in der Per-Protokoll-Population die Nicht-Unterlegenheit der ACT gegenüber Certolizumab (Δ4 %) und Tocilizumab (Δ-1 %), nicht aber Abatacept (Δ9 %; 95% KI 0,1-19 %) demonstriert werden. (1) Die Take Home-Message dürfte sein, dass sich bei frühzeitigem Therapiebeginn fast unabhängig von der gewählten Startbehandlung auch höher gesteckte Remissionsziele wie im CDAI oft erreichen lassen – bei konsequenter Umsetzung. Dass bei sehr früher RA in vielen Fällen eine Ersttherapie mit MTX und GK ausreicht, überrascht aber nicht wirklich und bestätigt letzten Endes einfach nur das in den Leitlinien empfohlene stufenweise Vorgehen.
CREDO1-Studie: Neuer Versuch mit direktem IL-6-Inhibitor
Nach dem späten Aus von Sirukumab in Phase-III war die direkte IL-6-Inhibition eigentlich schon abgeschrieben worden, zumal Phase-II-Daten zu Olokizumab als zweitem Vertreter dieser Substanzklasse eine minimal schwächere Effektivität im Vergleich zu Tocilizumab andeuteten. Dennoch wurde die Entwicklung von Olokizumab in Russland weitergetrieben und jetzt von Mark C. Genovese, Stanford (USA), und Kollegen die zudem in Bulgarien und Weißrussland durchgeführte erste randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie CREDO1 vorgestellt. Eingeschlossen wurden 428 Patienten mit einer trotz MTX mäßigen bis schweren RA, die bei fortgesetzter MTX-Therapie im Verhältnis 1:1:1 auf s.c. Olokizumab 64 mg alle 2 Wochen (Q2W) oder 64 mg alle 4 Wochen (Q4W) oder Placebo randomisiert wurden. Ab Woche 14 war zusätzlich eine Escape-Therapie mit SSZ und/oder HCQ möglich. Primärer Endpunkt war das ACR20-Ansprechen in Woche 12, als sekundäre Endpunkte wurden eine niedrige Krankheitsaktivität (DAS28-CRP ≤3,2) in Woche 12, die Veränderung im HAQ-DI bis Woche 12, in Woche 24 das ACR50-Ansprechen und Erreichen einer CDAI-Remission ≤2,8 sowie die Sicherheit erfasst.
Zwischen 91 und 94 % der Teilnehmer schlossen die 24-wöchige Studienphase ab. Beide Olokizumab-Regime (Q2W und Q4W) erreichten signifikant alle Endpunkte, so das ACR20-Ansprechen in Woche 12 (63,6 und 70,4 vs. 25,9 %), beim DAS28-CRP ≤3,2 in Woche 12 (33,6 und 38,7 vs. 3,5 %), im ΔHAQ-DI bis Woche 12 (-0,54 und -0,56 vs. -0,20) und in Woche 24 in Bezug auf das ACR50-Ansprechen (42,7 und 48,6 vs. 7,7 %; alle Vergleiche p<0,0001) und die CDAI-Remission ≤2,8 (8,4 und 7,7 vs. 0 %; p<0,001). Therapieassoziierte unerwünschte Ereignisse (TEAE) waren häufiger unter Olokizumab (58 und 57 vs. 44 %), zum Abbruch führten sie bei 4,9 und 3,5 vs. 0,7 % der Patienten. Auch schwere TEAE traten unter Olokizumab numerisch öfter auf. Es kam zu einem Todesfall (septischer Schock im Q2W-Arm), was aufgrund des Scheiterns von Sirukumab aufgrund leicht erhöhter Mortalität in Phase-III hier besonders zu beachten ist. Trotz durchaus respektabler Wirksamkeit und bis dato auch akzeptabler Sicherheit ist – auch angesichts des rein osteuropäischen Kollektivs – wohl kaum mit einer Weiterentwicklung für den europäischen Markt zu rechnen. (2) Generell geht der Trend weg von weiteren bDMARDs (derzeit wird lediglich der GM-CSF-Inhibitor Otilimab noch in Phase-III-Studien geprüft) und weiter hin zu den oralen tsDMARDs.
Orale tsDMARD-Therapie jenseits der JAK-Inhibition
Währen erste JAK-Inhibitoren bereits fest etabliert sind, tritt man bei den oralen Alternativen ein wenig auf der Stelle. Neu angesetzt wird jetzt an der IL-1-Rezeptor assoziierten Kinase 4 (IRAK4), die den Signalweg von Toll-like Rezeptoren (TLRs) und IL-1 moduliert. Spencer I. Danto, Cambridge (USA), und Kollegen stellten in Atlanta eine randomisierte, doppelblinde, aktiv- und placebokontrollierte Phase-IIb-Studie zu dem hoch selektiven und reversiblen IRAK4-Inhibitor PF-06650833 vor. Im Verhältnis 6:6:6:5:5:5 wurden hierin für 12 Wochen 269 Patienten mit mäßiger bis schwerer ACPA-positiver RA und ungenügendem Ansprechen auf MTX auf 1x täglich PF-06650833 20 mg, 60 mg, 200 mg, 400 mg (Tabletten mit verzögerter Wirkstofffreisetzung), Tofacitinib 2x 5 mg/Tag oder Placebo randomisiert. Primärer Endpunkt war die Veränderung bis Woche 12 im SDAI, sekundäre Endpunkte waren das ACR20/50/70-Ansprechen und die Veränderung bis Woche 12 im DAS28-4(CRP). In Bezug auf den primären Endpunkt wurde speziell für die 200-400 mg-Dosis ein signifikanter Vorteil versus Placebo gesehen (p≤0,005), ebenso im ACR50-Ansprechen (40,0 bzw. 43,8 %; p=0,04 bzw. p=0,016) und ΔDAS28-4(CRP) (je p<0,05). Das Sicherheitsprofil war akzeptabel mit 8 schweren UE, häufigste UE waren Infektionen und Infestationen, auch 3 Herpes zoster-Fälle traten auf. (3) Ob dieses Therapieprinzip bei der RA tatsächlich weiter verfolgt wird, bleibt ebenso abzuwarten wie im Fall der Bruton-Tyrosinkinase (BTK)-Inhibitoren.
Deeskalation: Ein erneuter Blick auf die TARA-Studie
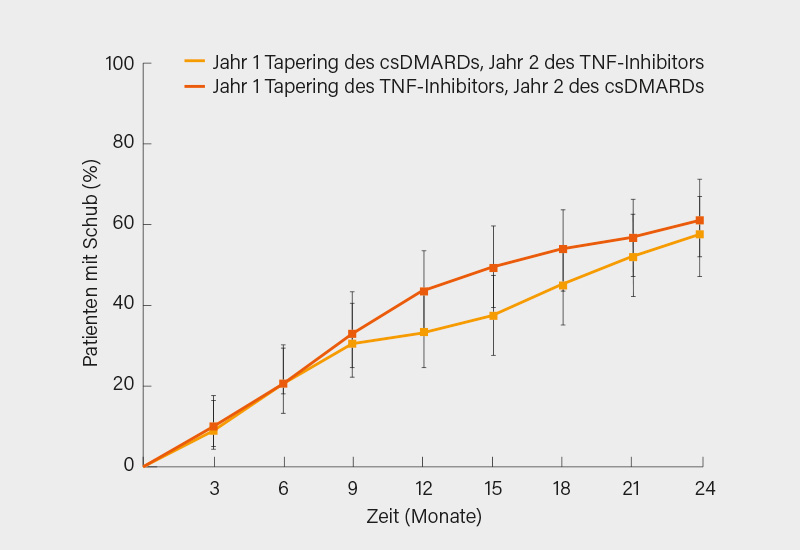
Mit der Frage, ob nach dem Erreichen einer Remission (hier ein DAS44 ≤2,4 und SJC ≤1) für ≥3 Monate unter einer Kombination aus einem csDMARD und bDMARD bei Patienten mit langjähriger RA die Reihenfolge des Therapieabbaus (erst das csDMARD, meistens MTX, oder erst der TNFα-Inhibitor) für den Erhalt der Remission entscheidend ist, hatte sich die randomisierte, einfach-verblindete, kontrollierte TARA-Studie beschäftigt. Nach 12 Monaten hatte sich gezeigt, dass im Fall einer kontrollierten, 3-stufigen Deeskalation (über 50 auf 25 % der Dosis, dann 0 %) beide Strategien ähnlich erfolgreich sind und damit die vorrangig ökonomisch begründete Empfehlung der EULAR-Leitlinie, zunächst das bDMARD auszuschleichen, bestätigt. Auf der ACR-Tagung 2019 präsentierten Elise van Mulligen, Rotterdam (Niederlande), und Kollegen nunmehr die finalen 2-Jahres-Daten dieser Studie. Im zweiten Jahr sollte, je nachdem ob das csDMARD oder der TNFα-Inhibitor als erstes abgesetzt wurde, das jeweils andere DMARD sukzessive ausgeschlichen werden. Primärer Endpunkt war die Anzahl von Patienten mit einem Schub (DAS44 >2,4 und/oder SJC >1). Bei den 189 Patienten mit Ausschleichen zunächst entweder des csDMARDs oder des TNFα-Inhibitors betrug die kumulative Schubrate nach 24 Monaten 61 vs. 62 % (p=0,35) (Abb.). Mit der ersten Strategie (erst das csDMARD raus) waren etwas mehr Patienten in der Lage, die Medikation auszuschleichen (32 vs. 21 %) und erreichten signifikant häufiger eine DMARD-freie Remission (16 vs. 8 %; je p<0,01). Im Hinblick auf den mittleren DAS, HAQ und den EQ-5D über die Zeit zeigte sich nach zwei Jahren jedoch kein Unterschied zwischen den beiden Ansätzen. Somit könnte man – trotz des ansonsten toten Rennens – minimale Vorteile dafür postulieren, doch zunächst das csDMARD auszuschleichen. (4)
AVERT-2-Studie: Deeskalation von Abatacept im Fokus
Mit Reihenfolge des Absetzen eines bDMARDs (hier Abatacept) oder csDMARD (hier MTX) nach erlangter Remission befasste sich auch die von Paul Emery, Leeds (Großbritannien), präsentierte randomisiert-kontrollierte Phase-IIIb-Studie AVERT-2. In dieser waren MTX-naive Patienten mit früher (<6 Monate), aktiver ACPA-positiver RA (SDAI >11) zunächst für 56 Wochen 3:2 mit s.c. Abatacept 125 mg/Woche plus MTX oder mit Placebo plus MTX behandelt worden. Nachfolgend wurden jene 147 Patienten, die unter Abatacept plus MTX eine anhaltende SDAI-Remission ≤3,3 in Woche 40 und 52 erreicht hatten, im Verhältnis 1:1:1 auf Abatacept 125 mg/Woche plus MTX für 48 Wochen, Abatacept 125 mg/2 Wochen plus MTX für 24 Wochen gefolgt von Placebo plus MTX für 24 Wochen oder Abatacept 125 mg/Woche plus Placebo re-randomisiert (die MTX- und GK-Dosis mussten stabil bleiben). Endpunkte waren die Anteile von Patienten in SDAI-Remission, die Veränderung im SDAI (nach Deeskalation bis Woche 48), Sicherheit und radiologische Progression in Woche 48.
Im Ergebnis blieben 74 % der Patienten auf wöchentlich Abatacept plus MTX in einer SDAI-Remission bis Woche 48, der Entzug von MTX resultierte in einem Abfall dieser Rate auf 64 %, die sich ab Woche 12 der Deeskalationsphase stabilisierte. Nach Halbierung (Spacing) von Abatacept sank die Remissionsrate von 88 auf 74 % in Woche 24 und dann weiter nach vollem Absetzen auf nur noch 48 % in Woche 48. Die adjustierte mittlere Veränderung im SDAI war in allen Abatacept-Armen numerisch gering, variierte aber und nahm nach dem Abatacept-Entzug zu. In allen Armen wurde eine anhaltende Hemmung der radiologischen Progression festgestellt und auch in puncto Sicherheit waren keine Unterschiede erkennbar. Das graduelle völlige Absetzen von Abatacept setzte somit (stärker als das sofortige von MTX) am stärksten den Remissionserhalt aufs Spiel. (5)
ARCTIC REWIND-Studie: csDMARDs gut absetzbar?
Zuletzt nun zu jenen RA-Patienten, die mit einer csDMARD-Therapie in eine anhaltende klinische Remission gelangten und bei denen sich nun gleichfalls die Frage nach der Möglichkeit eines Abbaus des eingesetzten csDMARDs stellt. Untersucht wurde dies in der gleichfalls als Late breaker von Siri Lillegraven, Oslo (Norwegen), und Kollegen vorgestellten randomisierten, kontrollierten Nicht-Unterlegenheits-Studie ARCTIC REWIND. Die darin eingeschlossenen 155 RA-Patienten mussten unter stabiler csDMARD-Therapie eine DAS44-Remission ohne ein geschwollenes Gelenk für ≥12 Monate aufweisen und wurden für 12 Monate 1:1 auf eine Beibehaltung oder Halbierung der Dosis des csDMARD (in 78,2 bzw. 84,4 % der Fälle war dies eine MTX-Monotherapie) randomisiert. Primärer Endpunkt war ein Krankheitsschub, definiert als Kombination aus DAS >1,6, ΔDAS >0,6 und ≥2 geschwollenen Gelenken oder einer übereinstimmenden Einschätzung von Arzt und Patient. Als Nicht-Unterlegenheit der Deeskalation wurde eine Marge von 20 % angelegt.
Bei 6,4 vs. 24,7 % der Patienten unter stabiler bzw. halbierter csDMARD-Therapie kam es zu einem Schub (95% KI 7,2-29,3 %), womit der Nachweis einer Nicht-Unterlegenheit verpasst wurde (das Ergebnis für die MTX-Monotherapie war ähnlich). Im stabilen csDMARD-Arm wurde bei 40 % der Teilnehmer nach dem Schub die Medikation eskaliert, im Halbdosis-Arm bei 94,7 %. Zu keiner radiologischen Progression binnen 12 Monaten kam es bei 79,5 vs. 62,7 %. Nach 12 Monaten waren im stabilen csDMARD- und Halbdosis-Arm 91,8 vs. 85,1 % der Patienten in einer DAS-Remission mit einem vergleichbaren Bild bei anderen Remissionskriterien. Zwar kam es im stabilen csDMARD-Arm zu numerisch mehr UE, seltener aber zu schweren UE (2,6 vs. 5,1 %). Insgesamt liefert die Studie in diesem Kollektiv bessere Argumente für eine Beibehaltung der bisherigen Therapie oder vorsichtigere Dosisreduktion. (6)
Als Lehre aus all diesen Studien zur Deeskalation nach dem Erreichen einer anhaltenden Remission kann gezogen werden, dass eine vorsichtige, schrittweise Dosisreduktion dem vollständigen Absetzen eines bDMARDs oder csDMARDs vorzuziehen ist. Letztlich sollte überdies die Entscheidung auch über die Reihenfolge das Ausschleichens auf individueller Basis gemeinsam von Arzt und Patient gefällt werden – die Präferenz der Patienten gilt es hierbei stets zu berücksichtigen.
Quellen:
1 Arthritis Rheumatol 2019; 71 (Suppl10): Late breaking Abstr. L09
2 Arthritis Rheumatol 2019; 71 (Suppl10): Late breaking Abstr. L12
3 Arthritis Rheumatol 2019; 71 (Suppl10): Abstr. 2909
4 Arthritis Rheumatol 2019; 71 (Suppl10): Abstr. 2906
5 Arthritis Rheumatol 2019; 71 (Suppl10): Late breaking Abstr. L11
6 Arthritis Rheumatol 2019; 71 (Suppl10): Late breaking Abstr. L08