Aktuelle Aspekte bei den Großgefäßvaskulitiden beleuchtete Prof. Dr. Nils Venhoff, Freiburg. Zu den RZA-Risikofaktoren zählt eine genetische Prädisposition – neue Loci wurden erst kürzlich in einer großen genomweiten Assoziationsstudie identifiziert. Bekannt ist eine Assoziation der RZA mit hämatologischen Malignitäten mit somatischen Mutationen und klonaler Hämatopoiese „als Bindeglied“. Relevant scheinen vor allem Tet-Methycytosin-Dioxygenase 2 (TET2)-Mutationen zu sein, die mit der RZA-Inzidenz (und wohl auch dem Risiko für Visusverlust) verbunden zu sein scheinen. Bis zu einer Integration genetischer Diagnostik in die Versorgung dürfte es aber noch ein weiter Weg sein. Jenseits von Umweltfaktoren (z. B. Infektionen) spielen Alterungsprozesse eine wichtige Rolle bei der RZA-Entstehung. Auch nimmt das Alter bei Diagnose Einfluss auf den Phänotyp, das Ischämierisiko, die Therapiestrategie und Glukokortikoid (GK)-assoziierte Nebenwirkungen. Eine große dänische Beobachtungsstudie ergab, dass neben den kumulativen GK-Dosen, ein Alter >70 Jahre und Komorbiditäten mit einem erhöhten Infektionsrisiko assoziiert waren.
Riesenzellarteriitis: Bildgebung und neue Therapieoptionen
In puncto Bildgebung scheint ein positives FDG-PET zu Beginn ein über 10 Jahre hinweg höheres Risiko für thorakale Aortenkomplikationen zu prädizieren. Auch zu bedenken: Im Ultraschall fanden sich bei 23 % der Patienten mit einer „reinen“ Polymyalgia rheumatica (PMR) Anzeichen einer subklinischen RZA. Eine solche war prädiktiv für ein höheres Rezidivrisiko der PMR-Patienten. Eine anamnestische PMR vor der Diagnose einer RZA war zudem mit schwereren RZA-Verläufen (häufigere Großgefäßbeteiligung, mehr Stenosen) verbunden. Bedeutsam ist die Verwendung validierter Scores: Hier empfiehlt sich beim Ultraschall die Nutzung des neuen OMERACT US-Scores (OGUS) und bei der MRT zur Bewertung entzündlicher Gefäßwandverdickungen der Magnetic Resonance Vasculitis Activity Score (MRVAS). Ein MRT mit Black Blood-Sequenz kann auch beim Aufspüren intraorbitaler RZA-Manifestationen (mit drohendem Visusverlust) hilfreich sein.
Zur Therapie der RZA: Hier wackelt womöglich eine Leitlinienempfehlung, nachdem in einer schwedischen Studie initial i.v.-Methylprednisolon (MP) keinen Vorteil gegenüber oralen GK im Hinblick auf Sehschärfe und Mortalität brachte, dafür aber mehr Nebenwirkungen (vor allem Typ-2-Diabetes) bot. Zwei Real-World-Studien lassen darauf schließen, dass ein an die GiACTA-Studie angelehntes rasches GK-Tapering über 26 Wochen machbar ist (bei aber hoher Rezidivrate von je 68 %, auch wenn es meist nur leicht Schübe waren). In Bezug auf Tocilizumab zeigte sich wiederum, dass nach erreichter Remission eine Dosisreduktion bzw. Intervallverlängerung (wie oft in der Praxis praktiziert) Vorteile gegenüber dem völligen Absetzen hat. Genauere Daten hierzu dürfte die MAGICA-Studie zum Tapern oder Stoppen von Tocilizumab liefern. Weitere wichtige Studien, die die Versorgungsrealität beeinflussen könnten, sind METOCIA, ein direkter Vergleich von Tocilizumab und dem in der Praxis noch häufig eingesetzten Methotrexat (MTX), sowie die METOCRITICS-Studie, in der nach dem Absetzen von Tocilizumab versucht wird, ob sich das danach bestehende Rezidivrisiko durch MTX (versus Placebo) reduzieren lässt.
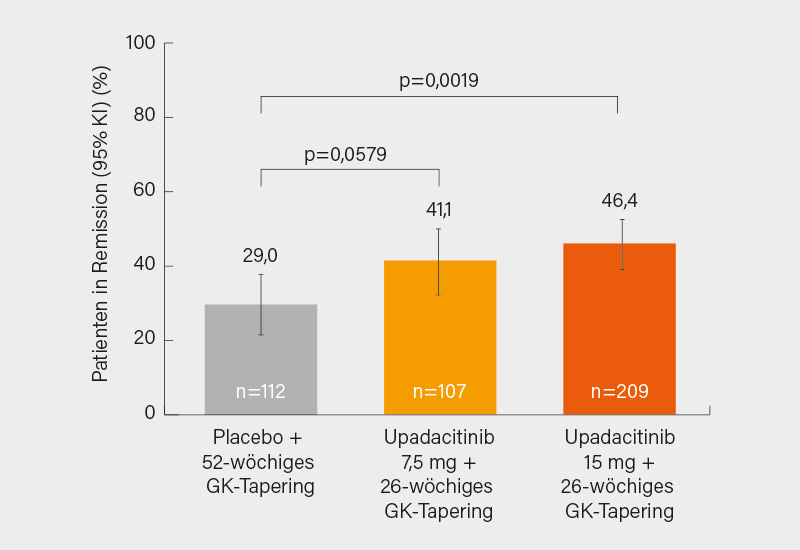
Künftig eine Alternative zu Tocilizumab könnte das erfolgreich in der auf dem EULAR 2024 vorgestellten Phase-III-Studie SELECT-GCA bei de-novo oder rezidivierender RZA geprüfte Upadacitinib darstellen. Der primäre Endpunkt einer anhaltenden Remission von Woche 12-52 wurde unter Upadacitinib 15 mg signifikant erreicht, auch wenn man sich vielleicht eine größere Differenz zu Placebo erhofft hätte (46 % bei 26-wöchigem vs. 29 % bei 52-wöchigem GK-Tapering) (Abb. 1). Auch bleibt abzuwarten, wie sich die Zulassungsbehörden angesichts der Altersrestriktionen bei JAK-Inhibitoren verhalten werden. Eine unbedenklichere Alternative könnte der in der deutschen Phase-II-Studie TiTAIN überzeugende Interleukin (IL)-17A-Inhibitor Secukinumab sein, der bei RZA und PMR derzeit in Phase-III-Studien zur Remissionsinduktion und GK-Einsparung untersucht wird (GCAptAIN bzw. REPLENISH). Auch bei PMR ist Tocilizumab (off-label) wirksam, mit dem in den USA auf Basis der Phase-III-Studie SAPHYR zugelassenen Sarilumab ist auch in Europa auf eine neue In-label-Therapie zu hoffen.
ANCA-Vaskulitiden: B-Zell-gerichtete Therapien im Fokus
Über neue Erkenntnisse zu den AAV berichtete Prof. Dr. David Jayne, Cambridge (Großbritannien). Zwar bedeuten die ACR/EULAR-Klassifikationskriterien aus 2022 einen klaren Schritt nach vorne, doch lohnt sich aus praktischen Aspekten ein detaillierterer Blick auf die Subgruppen. So wurden im internationalen FAIRVASC-Projekt bei Patienten mit GPA/MPA fünf Cluster mit distinkten Phänotypen und Outcomes identifiziert, die mit einem sehr unterschiedlichen Risiko für eine Nierenbeteiligung und -progression verbunden sind. Letzteres ist prognostisch äußerst bedeutsam, wie 20-Jahres-Langzeitdaten der EUVAS-Studien belegen – das Risiko für terminale Niereninsuffizienz (ESKD) nach 5 und 10 Jahren betrug 17 bzw. 22 %, eine solche war mit einer deutlich höheren Mortalität assoziiert. Ein Plasmaaustausch (PLEX) scheint das ESKD-Risiko über 12 Monate zu reduzieren, nicht aber die Mortalität. Auf Basis der PEXIVAS-Studie und deren Subanalysen wurde die PLEX in Leitlinien, etwa jene der EULAR aus 2022 oder den aktuell in Düsseldorf präsentierten DGRh-Empfehlungen, etwas abgestuft.
Die wichtigste Therapieoption ist Rituximab, mit dem aber keine ausreichend tiefe B-Zell-Depletion erreicht wird – überdies ist es (bereits kurzfristig) mit einem hohen Infektionsrisiko assoziiert. Derzeit werden daher verschiedene alternative B-Zell-Therapien erprobt, so in der Phase-II-Studie ObiVas der (inzwischen bei Lupusnephritis erfolgreich in Phase-III geprüfte) Anti-CD20-Antikörper Obinutuzumab. Andere Ansätze bestehen in Belimumab (Phase-II COMBIVAS-Studie), Anti-BAFF/-APRIL-Antikörpern (Atacicept, Povitacicept, Telitacicept – die beiden letzteren werden in Phase-II geprüft) oder dem Anti-BAFF-Rezeptor-Inhibitor Ianalumab. Auch die CD19 CAR-T-Zelltherapie rückt vermehrt in den Fokus, experimentell wurde bereits nachgewiesen, dass sie vor ANCA-induzierten akuten Nierenschäden schützt.
Ein weiterer Ansatz besteht im C5a-Rezeptorantagonisten Avacopan, für den neben einer Steroideinsparung (vor allem bei früher Gabe) deutlich positive Effekte auf die Nierenfunktion und inzwischen auch diffuse alveoläre Hämorrhagie belegt sind. Auch zu dem gegen C5a gerichteten Antikörper Vilobelimab laufen derzeit Phase-II-Studien bei GPA/MPA in der Remissionsinduktion (auch als Steroidersatz). Neue Ideen bestehen in der Cathepsin C-Inhibition zur Reduzierung der Neutrophilen-Aktivierung, was im MPO-ANCA-Tiermodell erfolgreich war, oder der CLDN1-Inhibition zur Hemmung der Fibrose bei rasch-progredienter Glomerulonephritis bei AAV.
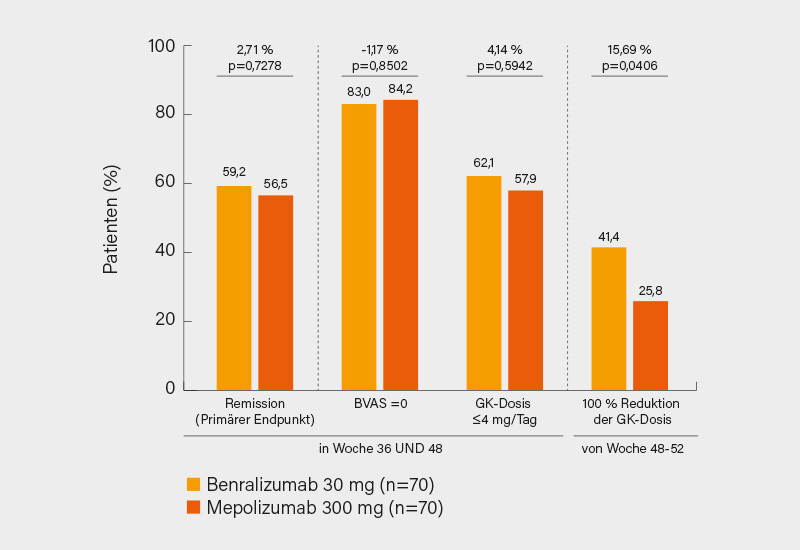
Doch zurück zur sehr nahen Zukunft: Nachdem Mepolizumab bei EGPA Einzug in die EULAR- (und DGRh) Leitlinie gehalten hat, steht mit dem in der Phase-III-Studie MANDARA erfolgreich geprüften Interleukin (IL)-5-Rezeptorantagonisten Benralizumab ein neuer Therapiekandidat unmittelbar vor der Zulassung. Bei mit Mepolizumab vergleichbaren Daten zur Remission in Woche 36 und 48 (BVAS =0, GK-Dosis ≤4 mg/Tag), scheint dieser womöglich leichte Vorteile in puncto Steroideinsparung aufzuweisen (Abb. 2).
Quelle: Klinische Sitzung „WIN Vaskulitis und WIN Myositis“, 21. September 2024