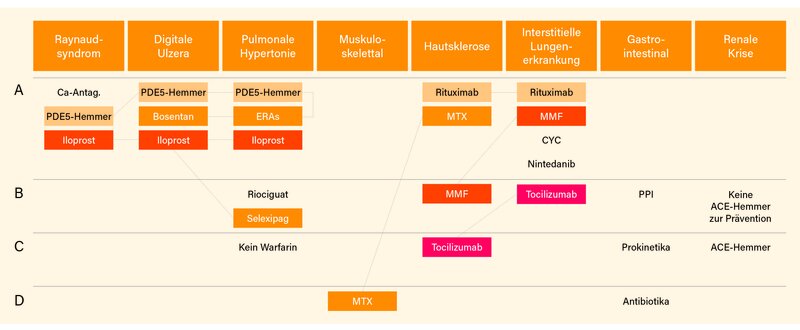
Wie üblich basieren die Empfehlungen auf einem systematischen Literaturreview und einem mehrstufigen Delphi-Abstimmungsverfahren. Nach einem Online-Survey wurden unter Berücksichtigung der letzten Recommendations von 2017 aus 212 neuen Fragestellungen 31 zu Interventionen priorisiert und in einem Konsensus-Hybrid-Meeting abgestimmt. Das Ergebnis sind 20 Empfehlungen (anstelle von 16 in 2017) zu acht klinischen Domänen mit einem Bezug zu SSc-Symptomen bzw. -Organbeteiligungen: Raynaud-Phänomen (RP), digitale Ulzera (DU), pulmonale arterielle Hypertonie (PAH), Hautfibrose, interstitielle Lungenerkrankung (ILD), muskuloskelettale Beteiligung, gastrointestinale (GI)-Beteiligung und renale Krise (SRC) (Abb. 1). Die meisten neuen Empfehlungen zielen auf die Hautfibrose und ILD ab und umfassen jetzt den Einsatz von Mycophenolat Mofetil (MMF), Nintedanib, Rituximab und Tocilizumab. So gibt es bei der Hautfibrose starke Empfehlungen für Rituximab, Methotrexat (MTX) und MMF, sowie bei der ILD für MMF, Cyclophosphamid, Rituximab, Nintedanib und schwächer für Tocilizumab. Bei Patienten mit schlechter Prognose gibt es eine separate Empfehlung für die autologe Stammzelltransplantation (HSCT).
Die Empfehlungen im Überblick
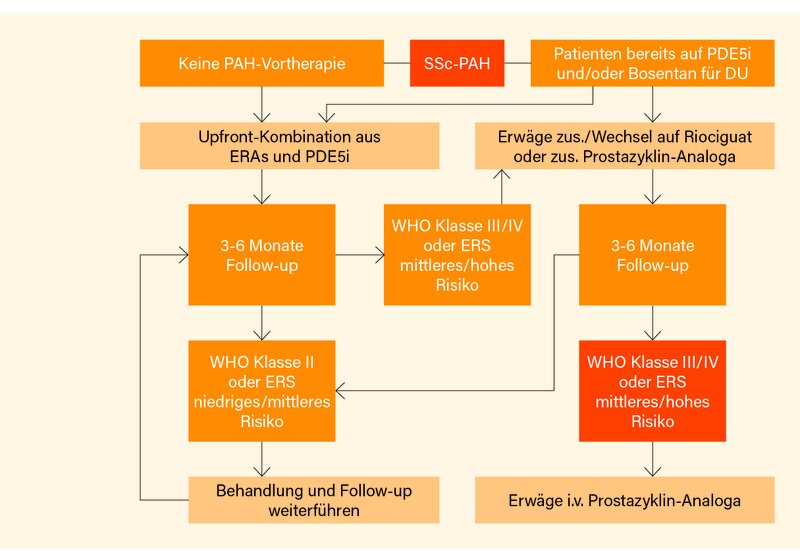
In Bezug auf die vaskulären Manifestationen wird ein therapeutisches Kontinuum betont, da im Wesentlichen dieselben Substanzklassen bei SSc-RP, SSc-DU und SSc-PAH eingesetzt werden. Bei SSc-RP sollte weiter eine Erstlinientherapie mit Calciumantagonisten vom Dihydropyridin-Typ, üblicherweise orales Nifedipin, eingesetzt werden (1A). Des Weiteren sollten Phosphodiesterase 5 (PDE5)-Inhibitoren für die Behandlung des SSc-RP erwogen werden (1A). Bei schwerem SSc-RP sollte nach dem Versagen oraler Therapien i.v. Iloprost erwogen werden (1A). Zur Behandlung von SSc-DU sollten PDE5-Inhibitoren und/oder i.v. Iloprost in Erwägung gezogen werden (1A). Zur Reduktion der Anzahl neuer digitaler Ulzera bei SSc-Patienten sollte Bosentan erwogen werden (1A). Spannender wird es nun bei der SSc-PAH: Die Kombination aus PDE5-Inhibitoren und Endothelin-Rezeptor-Antagonisten (ERA) sollte hier als Erstlinientherapie erwogen werden (1A). Bei SSc-Patienten mit einer fortgeschrittenen PAH (WHO-Klasse III und IV) sollte eine Behandlung mit i.v. Epoprostenol in Betracht gezogen werden (1A). Auch andere Prostazyklin-Analoga oder -Agonisten sollten für die Therapie der SSc-PAH erwogen werden (1B). Riociguat kann zur Behandlung von Patienten mit SSc-PAH erwogen werden (1B). Explizit nicht empfohlen wird der Einsatz von Antikoagulanzien (Warfarin) in der Therapie der SSc-PAH (2A), dies aber mit einer eher geringeren Empfehlungsstärke von C. Vorschläge zum konkreten, stufenweisen Vorgehen in Abhängigkeit von Vortherapie, Therapiedauer, Schwere/Risiko der PAH gemäß WHO bzw. ERS macht ein separater Therapiealgorithmus für die SSc-PAH (Abb. 2).
Einige Neuerungen bei Hautfibrose und ILD
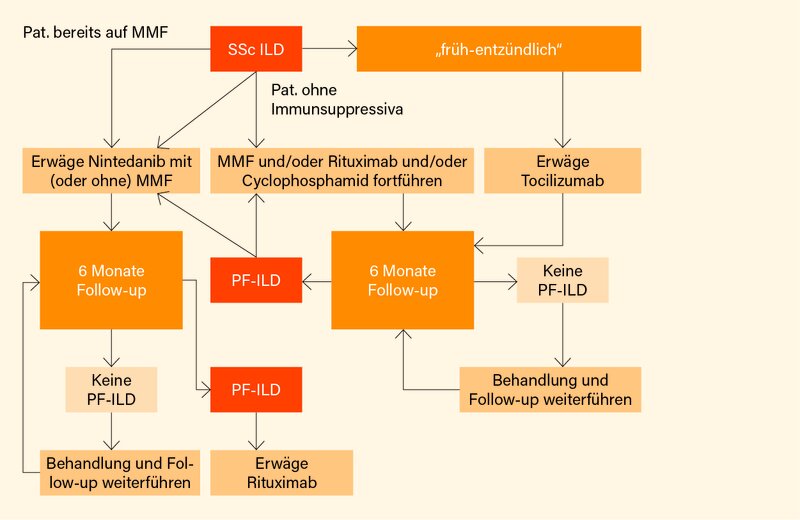
Klare Überschneidungen bezüglich der immunsuppressiven Therapien gibt es auch bei der Hautfibrose und ILD. Zur Behandlung der Hautfibrose sollten MTX (1B), MMF (1B) – letzteres nur mit Empfehlungsstärke B – und/oder Rituximab (1A) in Erwägung gezogen werden. Tocilizumab kann in Erwägung gezogen werden für die Therapie der Hautfibrose bei Patienten mit früher, entzündlicher diffus-kutaner (dc)SSc (1B), Empfehlungsstärke nur C. Bei Patienten mit SSc-ILD sollten für deren Behandlung MMF (1A), Cyclophosphamid (1A) oder Rituximab (1A) in Erwägung gezogen werden. Für die Behandlung der SSc-ILD (sprich der Fibrose) sollte zudem Nintedanib allein oder in Kombination mit MMF erwogen werden (1A). Auch Tocilizumab sollte zur Behandlung der SSc-ILD in Betracht gezogen werden (1B) – im Gegensatz zu den vorgenannten Therapieoptionen, denen alle die Empfehlungsstärke A zugesprochen wurde, ist es hier aber „nur“ B. Auch für die SSc-ILD wird ein eigenständiger Therapiealgorithmus vorgeschlagen, der die spezifische Abgrenzung von Toclizumab klar macht, und (in Abhängigkeit davon, ob eine progressiv-fibrosierende ILD vorliegt) zudem verdeutlicht, dass Kombinationen eine wichtige Rolle spielen (Abb. 3).
Bei schlechter Prognose HSCT eine Option
Nicht viel Neues gibt es zur bei SSc selten gewordenen renalen Krise: Sofort nach der Diagnosestellung einer SRC sollten ACE-Inhibitoren eingesetzt werden (4). Zur Prävention werden sie hingegen nicht empfohlen. Bei SSc-Patienten, die mit Glukokortikoiden (GK) behandelt werden, sollte eine regelmäßige Blutdruckkontrolle zur frühen Detektion einer SRC erfolgen (3) – beides Empfehlungsstärke C. Bei SSc-GIsollten Protonenpumpen-Inhibitoren (PPI) erwogen werden zur Behandlung der gastroösophagealen Refluxkrankheit (GERD) und Prävention ösophagealer Ulzera und Strikturen (3). Der Einsatz von Prokinetika sollte erwogen werden zur Therapie SSc-assoziierter symptomatischer Motilitätsstörungen (1B). Rotierende Antibiotika sollten in Erwägung gezogen werden zur Behandlung einer bakteriellen Überwucherung des Dünndarms (SIBO) (2B). Nichts getan hat sich in Bezug zur muskuloskelettalen Beteiligung: Hier bleibt es bei der Empfehlung, dass MTX erwogen werden sollte (2B) – Empfehlungsstärke ist lediglich D. Schlechte Prognose: Für selektierte Patienten mit früher dcSSc und schlechter Prognose kann bei Fehlen einer fortgeschrittenen kardio-respiratorischen Beteiligung eine hochintensive Immunsuppression (üblicherweise einschließlich Cyclophosphamid), gefolgt von einer autologen HSCT in Betracht gezogen werden (1A), Empfehlungsstärke A.
Take-Home-Message
Der Blick auf die umfangreiche Research Agenda verdeutlicht, dass der hohe „medical need“ weiter nur unzureichend abgebildet wird, so etwa bei vaskulären und GI-Manifestationen (insbesondere nicht-pharmakologische Interventionen bei digitalen Ulzera sind hier gefragt), der Frage nach der Effektivität von Interventionen mit Biologika bei kardiovaskulären SSc-Manifestationen, dem Management von Calcinosen und der optimalen antientzündlichen/-fibrotischen Therapie der SSc-ILD. Noch nicht Einzug gehalten hat die CAR-T-Zelltherapie, dies dürfte aber nur eine Frage der Zeit sein. Dennoch bleibt festzuhalten, das durchaus Fortschritte bei den fibrotischen Manifestationen (Haut, ILD) gemacht wurden und so manche Empfehlungen des „2023er“-Updates jetzt auf festeren Füßen stehen.
Quelle: Session „EULAR Recommendations II“, 15. Juni 2024