Zunächst zu dem bei Plaque-Psoriasis bereits zugelassenen Deucravacitinib. In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie POETYK PsA-1, die stellvertretend Désirée van der Heijde, Leiden (Niederlande), als Late-breaking Abstract präsentierte, wurden 670 bDMARD-naive Patienten (im Mittel 52 Jahre, ca. 50 % Frauen, 70 % auf csDMARDs) mit PsA-Diagnose für ≥3 Monate, SJC/TJC ≥3, aktiver/dokumentierter Psoriasis, hsCRP ≥ 3 mg/l und ≥1 PsA-bezogenen Gelenkerosion im Röntgen (Hand/Füße), also hohem Risiko für radiografische Progression, im Verhältnis 1:1 auf Deucravacitinib 6 mg/Tag (n=336) oder Placebo (n=334) randomisiert. Der primäre Endpunkt eines ACR20-Ansprechens nach 16 Wochen wurde (unabhängig von einer Begleittherapie mit csDMARDs oder dem Baseline-hsCRP-Wert) unter Deucravacitinib versus Placebo signifikant häufiger erreicht (54,2 vs. 34,1 %; p<0,0001).
Deucravacitinib: Steigendes Ansprechen bis Woche 52
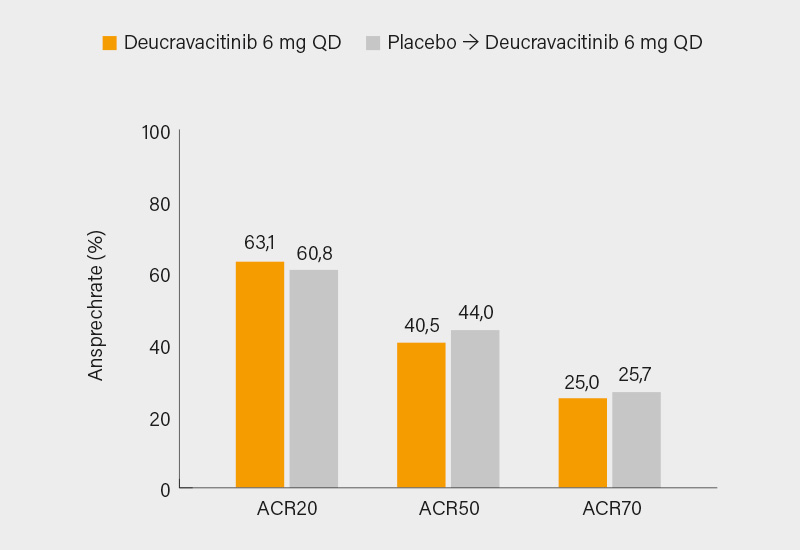
Von Woche 16 bis 52 wurden die Placebo-Patienten auf Deucravacitinib umgestellt. Bis Woche 24 kam es zu einer weiteren Verbesserung des Ansprechens, das bis Woche 52 aufrechterhalten wurde. So erreichten in Woche 52 63,1 (durchgehend Deucravacitinib) bzw. 60,8 % (von Placebo umgestellt) der Patienten ein ACR20-Ansprechen, sowie 40,5 bzw. 44,0 % und 25,0 bzw. 25,7 % ein ACR50/70-Ansprechen (Abb.). Auch andere Parameter wie minimale Krankheitsaktivität (MDA; 33,9 bzw. 34,4 %) oder das PASI 75-Ansprechen (66,0 bzw. 51,8 %) verbesserten sich im Verlauf bis Woche 52, dasselbe galt für PROs (HAQ-DI, SF-36, FACIT-Fatigue) sowie die Resolution von Enthesitis und Daktylitis. Die Hemmung der zu Woche 16 beobachteten radiografischen Progression blieb bis Woche 52 bestehen, mit einer Veränderung ab Baseline im PsA-modifizierten Sharp-van der Heijde (SvdH)-Score von 0,71 bzw. 0,90, als Nicht-Progressoren wurden 73,3 bzw. 66,5 % der Teilnehmer eingestuft. Das Sicherheitsprofil war ebenso wie in der POETYK PsA-2-Studie auch über 52 Wochen positiv mit nur wenigen schweren unerwünschten Ereignissen (UE) oder damit assoziierten Studienabbrüchen. Weder MACE, VTE noch opportunistische Infektionen wurden unter dem selektiven TYK-2-Hemmer beobachtet. (1) Mit hochwirksamen bDMARDs (Anti-IL-23, -17A und -17A/F) kann Deucravacitinib wohl nicht ganz mithalten, bei leichter bis moderater PsA dürfte es aber künftig eine interessante Option sein.
Izokibep: Gute 52-Wochen-Daten, aber keine Zukunft
Als Late breaking-Poster stellten Philip J. Mease, Seattle (USA), und internationale Kollegen die 52-Wochen-Ergebnisse der randomisierten, doppelblinden, placebokontrollierten Phase-IIb/III-Studie zu dem „small proteine“ Izokibep vor, von dem man sich Vorteile gegenüber herkömmlichen IL-17A-Inhibitoren erhoffte. In der Studie wurden 343 Patienten (im Mittel ca. 51 Jahre, BMI 30, Zeit seit Diagnose 6,5 Jahre, 55 % Männer) mit aktiver PsA (SJC/TJC ≥3) für ≥6 Monate und unzureichendem Ansprechen, Intoleranz oder Kontraindikation auf NSAR, csDMARDs und/oder TNF-Inhibitoren im Verhältnis 1:1:1 auf s.c. Izokibep 160 mg alle 2 Wochen (Q2W), 160 mg/Woche (QW) oder Placebo randomisiert, ab Woche 16 behielten die Verum-Patienten ihre Dosierung bei, jene auf Placebo wechselten auf Izokibep 160 mg QW. Zu Woche 16 hatten 43 (Q2W) und 40 % (QW) vs. 15 % ein ACR50-Ansprechen erreicht, bis Woche 52 stieg dieses auf 50 (weiter Q2W), 57 (weiter QW) und 51 % (Placebo/QW) an. Ein ACR70-Ansprechen erreichten zu diesem Zeitpunkt 36, 42 und 42 % der Patienten, einen PASI 100 55, 64 und 58 % sowie eine MDA 47, 52 und 47 %. Eine Resolution der Enthesitis gelang in ca. 50 % der Fälle. Die Verträglichkeit war gut, schwere UE selten (4-7 %) und die Raten von Colitis ulcerosa bzw. oraler Candidiasis (je 0-1 %) sehr niedrig. (2) Dennoch hat sich der Hersteller gegen eine Weiterentwicklung von Izokibep in dieser Indikation entschieden. Weiter hoffen darf man hingegen auf den IL-17A/F-Nanokörper Sonelokimab – Phase-III-Studien bei PsA laufen bereits.
H2H-Studie: Vorteile von Secukinumab vs. Ustekinumab
Ein weiterer Late breaker war die von Frank Behrens, Frankfurt/M., und Kollegen vorgestellte randomisierte, doppelblinde, aktiv-kontrollierte AgAIN-Studie mit dem direkten 1:1-Vergleich von Secukinumab 300 mg s.c. (n=56) und Ustekinumab 45/90 mg s.c. (n=63) bei 119 PsA-Patienten (im Mittel 53,5 Jahre, ca. 67 % Frauen, Körpergewicht >100 kg bei 30,4 vs. 22,2 %) mit Versagen auf oder Intoleranz von TNF-Inhibitoren (meistens Adalimumab, 68,9 %). Die Therapieabbruchraten waren deutlich höher unter Ustekinumab versus Secukinumab (25,4 vs. 3,6 %), meistens aufgrund fehlendem Ansprechen oder Wirkverlust – die mittlere Expositionsdauer betrug 24,3 (Secukinumab) bzw. 21,5 Wochen (Ustekinumab). Den primären Endpunkt eines HAQ-DI-Ansprechens in Woche 28 erreichten in einer rein deskriptiven Analyse numerisch mehr Patienten unter Secukinumab (57,1 vs. 27,0 %). Klare Vorteile des IL-17A-Inhibitors zeigten sich zu Woche 28 auch in sekundären Endpunkten wie dem PASI 75/90/100-Ansprechen (60,7/48,2/37,5 % vs. 46,0/39,7/27,0 %), dem Erreichen einer MDA (35,7 vs. 22,2 %) und dem ACR20/50/70-Ansprechen (73,2/48,2/28,6 % vs. 49,2/23,8/12,7 %) sowie in puncto Schmerzen, Enthesitis und Daktylitis. Es zeigte sich für beide Antikörper das bereits etablierte Sicherheitsprofil ohne große Differenzen. Auch wenn das höhere Ansprechen auf den IL-17A-Inhibitor den klinischen Erfahrungen entsprechen dürfte, wurde dies nun erstmals auch in einer kontrollierten H2H-Studie demonstriert. (3)
Quellen:
1 Arthritis Rheumatol 2025; 77(Suppl. 9): Abstr. LB20
2 Arthritis Rheumatol 2025; 77(Suppl. 9): Abstr. LB08
3 Arthritis Rheumatol 2025; 77(Suppl. 9): Abstr. LB06