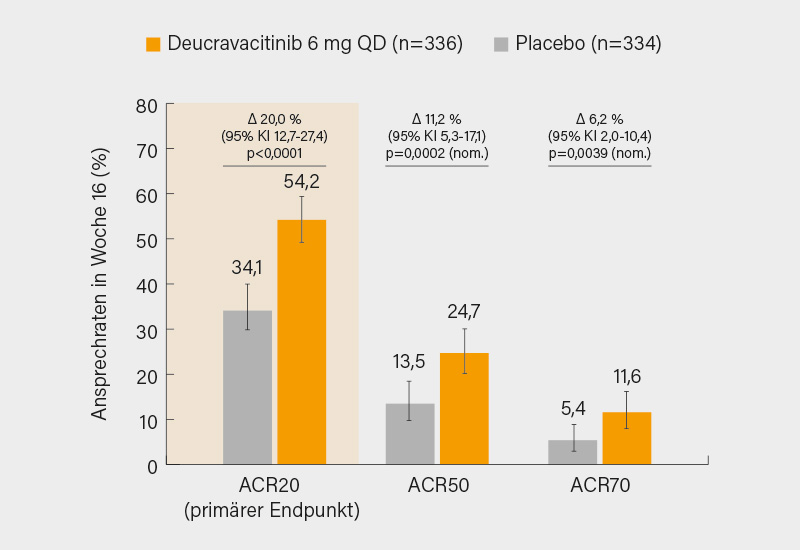
Zunächst zu dem bei Plaque-Psoriasis bereits zugelassenen TYK-2-Inhibitor Deucravacitinib. In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie POETYK PsA-1, über die stellvertretend Désirée van der Heijde, Leiden (Niederlande), berichtete, wurden 670 bDMARD-naive Patienten (im Mittel 52 Jahre, ca. 50 % Frauen, 70 % auf csDMARDs) mit PsA-Diagnose für ≥3 Monate, SJC/TJC ≥3, aktiver oder dokumentierter Psoriasis, hsCRP ≥3 mg/l und ≥1 PsA-bezogenen Gelenkerosion im Röntgen (Hand/Füße), also hohem Risiko für radiografische Progression, im Verhältnis 1:1 auf Deucravacitinib 6 mg/Tag (n=336) oder Placebo (n=334) randomisiert. Der primäre Endpunkt eines ACR20-Ansprechens nach 16 Wochen wurde (unabhängig von csDMARDs oder Baseline-hsCRP) unter Deucravacitinib signifikant häufiger erreicht (54,2 vs. 34,1 %; p<0,0001). Auch das ACR50/70-Ansprechen (24,7 vs. 13,5 %; p=0,0002 bzw. 11,6 vs. 5,4 %; p=0,0039) war höher (Abb. 1), ebenso zeigten sich signifikante Vorteile in sekundären Endpunkten wie PASI 75 (51,9 vs. 7,1 %; p<0,0001), minimaler Krankheitsaktivität (MDA) (19,0 vs. 10,2 %; p=0,0012) sowie HAQ-DI und Lebensqualität (SF-36 PCS). Nominal signifikante Vorteile zeigten sich für Fatigue, Daktylitis und Enthesitis (hier nur im SPARCC-Score) sowie im DAS28-CRP.
Deuvravacitinib mit überzeugenden Phase-III-Daten
Während die Primäranalyse nach 16 Wochen keinen signifikanten Vorteil bei der radiografischen Progression (PsA-modifizierter van-der-Heijde-Sharp-Score [vdH-S]) ergab, wurde in einer Post-hoc-Analyse mit einer nicht parametrischen Methodik doch eine signifikante Hemmung der strukturellen Progression unter Deucravacitinib beobachtet. Nebenwirkungen waren rar, mit einer Inzidenz ≥5 % fielen nur Infektionen der oberen Atemwege auf (5,1 vs. 3,0 %). Auch schwere unerwünschte Ereignisse (sUE: 1,8 vs. 2,4 %) und Studienabbrüche (2,4 vs. 1,8 %) waren selten. Kardiovaskuläre Komplikationen (MACE), Thromboembolien (VTE), Malignome oder opportunistische Infektionen wurden nicht verzeichnet. (1)
Philip J. Mease, Seattle (USA), und Kollegen präsentierten die randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie POETYK PsA-2, in die (bei mit Ausnahme der hier nicht geforderten Gelenkerosion identischen Einschlusskriterien) 729 PsA-Patienten eingingen, die bDMARD bzw. TNF-Inhibitor (TNFi)-naiv waren oder ≤2 TNFi (für PsA oder Psoriasis) nicht vertragen hatten (im Mittel 49 Jahre, ca. 51 % Frauen, ca. 13 % TNFi-Vortherapie, cs. 62 % auf csDMARDs). Diese wurden im Verhältnis 3:3:1 für 16 Wochen auf Deucravacitinib 6 mg/Tag (n=312), Placebo (n=312) oder Apremilast 2x 30 mg/Tag (n=105; als Sicherheits-Referenzarm) randomisiert, ab Woche 16 setzen die Verum- und Apremilast-Gruppen die Therapie bis Woche 52 fort, die Placebo-Patienten wechselten auf Deucravacitinib.
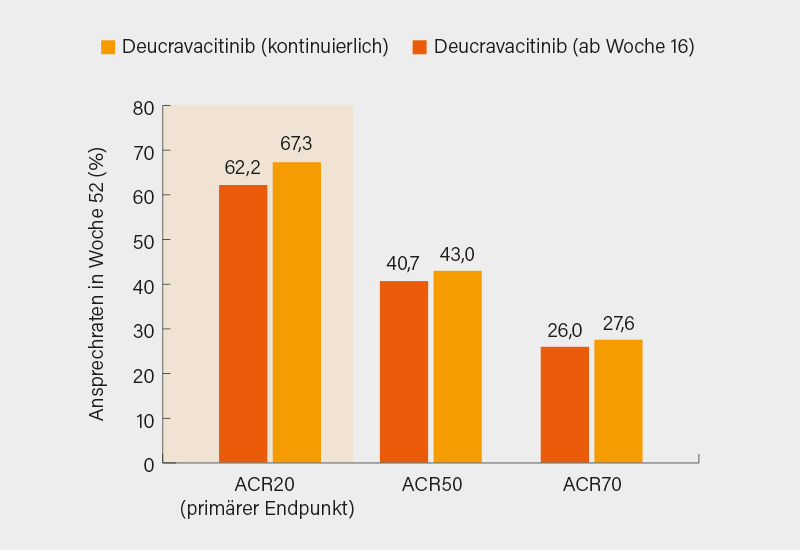
Der primäre Endpunkt ACR20-Ansprechen in Woche 16 wurde mit Deucravacitinib signifikant gegenüber Placebo erreicht (54,2 vs. 39,4 %; p=0,0002) mit ähnlichen Trends bei ACR50/70 (28,8 vs. 16,3 % bzw. 10,6 vs. 5,4 %). Bis Woche 52 stiegen die Ansprechraten sowohl mit fortgeführter oder ab Woche 16 erfolgter Deucravacitinb-Therapie deutlich an (ACR20/50/70: 62,2/67,3 %, 40,7/43,0 % bzw. 26,0/27,6 %; Abb. 2). Zu Woche 52 erreichten überdies 53,9/59,7 % der Teilnehmer einen PASI 75 und 41,7/36,9 % eine MDA. Auch im DAS28-CRP, HAQ-DI, SF-36 PCS und FACIT-Fatigue zeigten sich anhaltende Verbesserungen. Erneut waren sUE sehr selten, bis Woche 52 kam es dazu bei 4,5 (Placebo/Deucravacitinib), 5,8 (Deucravacitinib) und 9,5 % (Apremilast) der Patienten. Wieder gab es keine Signale in puncto MACE, VTE, Malignitäten oder opportunistischen Infektionen. Angesichts der guten Wirksamkeit und des vorteilhaften Sicherheitsprofils ist von einer Zulassung auch bei PsA auszugehen. (2)
Guselkumab hemmt die radiografische Progression
Über die Ergebnisse der randomisierten, doppelblinden, placebokontrollierten Phase-IIIb-Studie APEX berichtete wiederum Philip J. Mease. Hierin wurden 1.020 Patienten mit aktiver bDMARD-naiver PsA (SJC/TJC ≥3, CRP ≥0,3 mg/dl) und ≥2 Gelenken mit Erosionen (Hände/Füße) trotz csDMARDs, Apremilast oder NSAR (im Mittel 53 Jahre, 45 % Frauen, mittlerer vdh-S-Score 27,0, Erosionsscore 13,5, SJC 11,9, TJC 20,7) im Verhältnis 5:7:7 für 24 Wochen auf s.c. Guselkumab 100 mg alle 4 Wochen, 100 mg in Woche 0 und 4, dann alle 8 Wochen oder Placebo alle 4 Wochen randomisiert. Primärer Endpunkt war der ACR20, wichtigster sekundärer Endpunkt die mittlere Veränderung im für PsA modifizierten vdH-S. Unter Guselkumab alle 4 bzw. 8 Wochen erreichten nicht nur signifikant mehr Patienten in Woche 24 ein ACR20-Ansprechen (67 bzw. 68 % vs. 47 %; p<0,001), auch die radiologische Progression war signifikant geringer (ΔvdH-S-Score: 0,55 bzw. 0,54 vs. 1,35; p=0,002 bzw. p<0,001). Ähnliche Effekte zeigten sich für Gelenkspaltverschmälerung, Erosionsscore und den Anteil der Patienten ohne radiologische Progression – dies bei guter Sicherheit. (3)
Vorteile für „Hit hard and early“ bei ungünstiger Prognose
Die EULAR-Leitlinie rät bei PsA-Patienten zu einer Treat-to-target (T2T)-Strategie mit einem Step-up-Vorgehen, bei schlechter Prognose rasch beginnend mit einem csDMARD, bei relevanter Hautbeteiligung präferenziell Methotrexat (MTX), bei inadäquatem Ansprechen gefolgt vom einem zweiten csDMARD und dann einem bDMARD (bzw. JAK-Inhibitor). Diese Strategie wurde in gemischten Kollektiven durch zwei RCTs (GolMePsA, STAMP) gestützt. Dass dieses Vorgehen für Patienten mit ungünstiger Prognose nicht ideal ist, zeigt die von Laura C. Coates, Oxford (Großbritannien), vorgestellte randomisierte, kontrollierte SPEED-Studie. In dieser wurden 192 Patienten (mittlerer PASDAS 5,6/10) mit ≥5 betroffenen Gelenken, CRP >5 mg/dl und struktureller Gelenkschädigung (Röntgen/MRT) im Verhältnis 1:1:1 auf eine initiale csDMARD Step-up-Strategie, csDMARD-Kombination (MTX plus Sulfasalazin oder Leflunomid) oder TNFi-Therapie (MTX plus Adalimumab) randomisiert. Bis Woche 24 fiel der PASDAS auf 4,7 (Step-up), 4,1 (csDMARD-Kombi; Δ-0,69; p=0,0232) und 3,7 Punkte (TNFi-Kombi; Δ-1,09; p=0,0007). Ein gutes PASDAS-Ansprechen (Score ≤3,2 oder Reduktion um ≥1,6 Punkte) erreichten 7,5 vs. 31,2 (p=0,003) bzw. 45,3 % (p<0,001) der Patienten in Woche 24, nach 48 Wochen zeigte sich immer noch ein Vorteil der frühen csDMARD- (34,9 %) und TNFi-Kombination (40,0 %) gegenüber der Step-up-Strategie (24,4 %; je p<0,05). Bei vergleichbarem Sicherheitsprofil (jenseits der höheren Infektionsrate schnitt die TNFi-Kombination sogar am besten ab) sollte bei solchen Patienten also direkt eine aggressivere Strategie gefahren werden. (4)
Nur kurz erwähnt sei die „Neuauflage“ der STAMP-Studie zum Vergleich zweier T2T-Strategien bei 120 Patienten mit früher PsA (Secukinumab plus MTX 15 mg/Woche vs. MTX 25 mg/Woche, jeweils plus i.m. Triamcinolon 80 mg; mit nachfolgender Eskalation, z. B. Wechsel/Zugabe auf/von TNFi in beiden Gruppen). Trotz verfehltem primären Endpunkt waren beide Strategien sehr effektiv mit einer nach drei Monaten „robusteren“ Effektivität der intensiveren Secukinumab-Starttherapie über verschiedene PsA-Domänen, höheren initialen Retentionsraten und seltenerer Therapieeskalation bzw. seltenerem Switchen. (5)
Bei einer Difficult-to-Manage/Therapierefraktären (D2M/TR) PsA, die, wie Helena Marzo-Ortega, Leeds (Großbritannien) auf einer Leitlinien-Session berichtete, u. a. als Versagen auf ≥2 b/tsDMARD mit ≥2 Wirkmechanismen definiert wird, kann auch die Kombination aus einem b- und tsDMARD sinnvoll sein. Ersten kanadischen Daten zufolge scheinen Kombinationen aus IL-17- oder IL-23- und JAK- oder TYK-2-Inhibitoren sowie TNFi plus TYK-2-Inhibitor oder bDMARD plus Apremilast relativ sicher zu sein. (6)
Quellen:
1 Ann Rheum Dis 2025; 84 (Suppl 1): 313 (LB0001)
2 Ann Rheum Dis 2025; 84 (Suppl 1): 84 (OP0095)
3 Ann Rheum Dis 2025; 84 (Suppl 1): 321 (LB0010)
4 Ann Rheum Dis 2025; 84 (Suppl 1): 77 (OP0089)
5 Ann Rheum Dis 2025; 84 (Suppl 1): 80 (OP0092)
6 Ann Rheum Dis 2025; 84 (Suppl 1): 78 (OP0090)