METOGIA: Tocilizumab und MTX im H2H-Vergleich
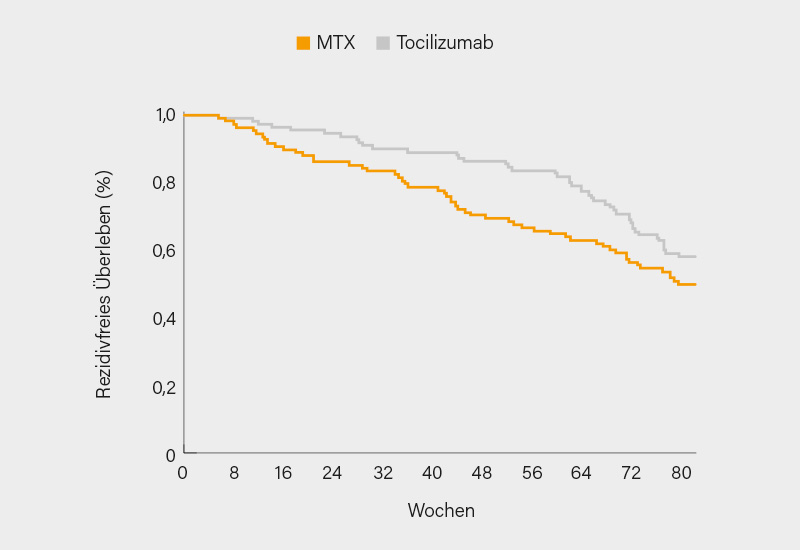
Die 78-Wochen-Daten der offenen METOGIA-Studie zum H2H-Vergleich von Tocilizumab 162 mg s.c. und MTX 0,3 mg/kg/Woche s.c. (<20 mg/Woche) kombiniert mit einem GK-Tapering (42 Wochen bei de-novo und 36 Wochen bei rezidivierender RZA) bei 230 neu diagnostizierten oder rezidivierenden Patienten mit aktiver RZA (innerhalb von 6 Wochen vor Randomisierung) über 52 Wochen mit Nicht-Unterlegenheits-Design stellten französische Rheumatologen um Maxime Samson, Dijon, vor. Primärer Endpunkt war der Anteil von ohne Rezidiv überlebenden Patienten (und ohne Abweichung vom GK-Tapering) bis Woche 78. Remission war definiert als keine RZA-Symptomatik und CRP ≤10 mg/l, ein Rezidiv als Symptome einer aktiven RZA unabhängig vom CRP-Wert. Von den 218 auswertbaren Patienten der ITT-Population (Tocilizumab, n=110; MTX, n=108) hatten 74 % eine de-novo und 26 % eine rezidivierende RZA.
Zu Woche 78 erreichten den primären Endpunkt 37 % der Patienten unter MTX und 46 % unter Tocilizumab (Differenz 9 %; 95% KI -4 bis 22 %), womit die vorab definierte Nicht-Unterlegenheitsmarge von 20 % nicht erfüllt wurde. Somit war MTX in der ITT-Population Tocilizumab nicht nicht-unterlegen (p=0,054). Allerdings war vice versa Tocilizumab auch MTX in Woche 78 nicht überlegen (p=0,16). Das Rezidiv-freie Überleben ist der Abb. zu entnehmen. Deutlicher war der Vorteil von Tocilizumab im sekundären Endpunkt Rezidiv-freies Überleben plus eingehaltenes GK-Tapering in Woche 52 (70 vs. 54 %; p=0,01) und Rezidiv-freies Überleben in Woche 52 (83 vs. 67 %; p=0,006). Keine relevante Differenz zeigte sich bei der kumulativen GK-Dosis in Woche 52 und 78. Schwere unerwünschte Ereignisse (UE) traten ähnlich oft auf, Todesfälle waren aber unter MTX häufiger (n=6 vs. 1). Insgesamt schnitt Tocilizumab im Remissionserhalt und in der Rezidivprävention durchaus besser ab (Woche 52) als MTX, es bleiben noch die Ergebnisse der Per-Protokoll-Analyse abzuwarten. (1)
SELECT-GCA: 2-Jahres-Daten zu Upadacitinib
In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie SELECT GCA wurde für Upadacitinib 15 mg/Tag eine häufigere Remission, weniger RZA-Schübe und geringere kumulative GK-Dosis in Woche 52 nachgewiesen. Den mit Spannung erwarteten zweiten Teil der Studie, eine 52-wöchige verblindete Extensionsphase stellten nun Wolfgang Schmidt, Berlin, und internationale Kollegen vor.
In Phase 2 gingen 181 Patienten aus Phase 1 ein, die eine für ≥24 Wochen anhaltende Remission mit 26-wöchigem GK-Tapering in Woche 52 erreicht hatten. Bis Woche 104 blieb die Remission bei 68,6 % der Patienten, die Upadacitinib fortführten, erhalten, im Vergleich zu nur 28,6 %, die in Woche 52 auf Placebo wechselten (p<0,0001). Das Risiko für einen Schub war um 90 % geringer (15,5 vs. 59,1 %; p<0,0001). Die fortgeführte Therapie mit Upadacitinib zeigte auch in anderen sekundären Endpunkten Vorteile, z. B. bei der kumulativen GK-Dosis (1.528 vs. 2.204 mg; p<0,0001) und vollständigen Remission in Woche 104 (73,1 vs. 28,6 %; p<0,0001). Schwere UE inklusive Infektionen waren unter Upadacitinib seltener.
Häufiger waren mit der 15 mg-Dosis allerdings Herpes Zoster und eine erhöhte Kreatinkinase. In diesem älteren Kollektiv (im Mittel ca. 71 Jahre) wurden über zwei Jahre hinweg aber keine MACE unter Upadacitinib verzeichnet. Wie bei Tocilizumab ist (wohl eher noch häufiger) aber bei Absetzen mit einem Rezidiv der RZA zu rechnen. (2)
Kurzer Exkurs zur Polymyalgia rheumatica
Zwischen RZA und Polymyalgia rheumatica (PMR) gibt es mannigfaltige Überschneidungen. Zur PMR selbst wurden auf dem ACR 2025 kaum neue Studien vorgestellt. Auch wenn die entsprechenden Daten noch ausstehen, wurde in Chicago aber natürlich das nach den überaus positiven Phase-II-Ergebnissen der TitAIN-Studie unerwartete „Scheitern“ des IL-17A-Inhibitors Secukinumab in der Phase-III-Studie GCaptAIN bei RZA diskutiert. Über die Gründe kann man derzeit auf Basis lediglich der Vorab-Presseinformation nur spekulieren. Umso erfreulicher war, dass vor dem Kongress aus einer weiteren Vorab-Meldung bekannt wurde, dass im Gegensatz dazu die bei PMR durchgeführte Phase-III-Studie REPLENISH zu Secukinumab den primären Endpunkt sowie alle sekundären Endpunkte erreicht hat. Voraussichtlich auf dem EULAR in London wird man mehr zu beiden Studien erfahren.
Quellen:
1 Arthritis Rheumatol 2025; 77(Suppl. 9): Abstr. 0891
2 Arthritis Rheumatol 2025; 77(Suppl. 9): Abstr. 0776