Mit der Balance zwischen der hohen Effektivität der JAK-Inhibitoren und deren Risikoprofil beschäftigte sich Prof. Dr. Klaus Krüger, München. Deren Vorteile liegen auf der Hand: Orale Verfügbarkeit, kurze Halbwertszeit (damit verbunden: rasch einsetzende Wirkung, schneller Wirkspiegelabfall bei Absetzen z. B. aufgrund einer Infektion und kurze Ausschleichphase vor Operationen) und oft ausreichende Effektivität in Monotherapie. Letzteres spiegeln auch Daten der Kerndokumentation wider, wo JAK-Inhibitoren zu ungefähr 70 % als Monotherapie gegeben wurden – ein systematisches Review ergab kaum Wirkunterschiede zwischen einer Mono- und Kombinationstherapie.
Gegenüber anderen Biologika, vor allem TNF-Inhibitoren, wurden in klinischen und Real-World-Studien Vorteile in der Wirksamkeit belegt, so etwa in der H2H-Studie Perfect-RA, in der Baricitinib versus TNF-Inhibitoren nach 12 Wochen in der DAS28-CRP-Remission nach 12 Wochen überlegen war (74 vs. 47 %) – dies auch im Verlauf über 48 Wochen. Zudem zeigten sich laut Krüger beispielsweise in der Swiss SCQM-RA-Kohorte Vorteile (wieder für Baricitinib) im Drug-Survival nach 2 Jahren gegenüber TNF-Inhibitoren (Hazard Ratio, HR 1,85) und anderen Biologika (HR 1,18). Inzwischen verdichten sich auch Hinweise auf eine gute Effektivität (selbst bei bDMARD-Vortherapie) bei Patienten mit RA-assoziierter interstitieller Lungenerkrankung (ILD).
Update zur Sicherheit von JAK-Inhibitoren
Neu veröffentlicht wurde ein systematischer Review über 42 H2H-Studien in verschiedenen Indikationen zur Sicherheit von JAK- im Vergleich zu TNF-Inhibitoren. Weder in Bezug auf schwere Infektionen, Malignitäten noch schweren kardiovaskulären Ereignissen (MACE) war – aber nach zumeist kurzem Follow-up – eine signifikante Differenz erkennbar, abgesehen von venösen Thromboembolien (VTE; HR 1,26). Auch im RABBIT-Register waren bei RA in puncto MACE keine Unterschiede nachweisbar, auch nicht bei kardialen Hochrisikopatienten gemäß der in ORAL Surveillance verwendeten Definition.
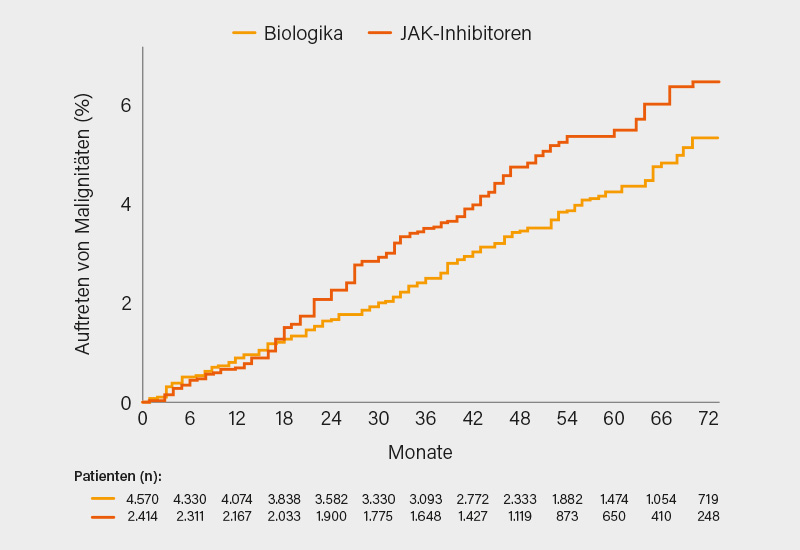
Etwas anders ist die Lage in Bezug auf Malignitäten, die sich unter JAK-Inhibitoren häufiger fanden (Inzidenzrate, IR 11,6 vs. 8,9 pro 100 Patientenjahre) – etwa ab Monat 16 bis 18 wurde die Differenz augenfällig (Abb.). Jedoch ist Krüger zufolge noch unklar, ob es sich um eine „echte Risikoerhöhung“ handelt, oder ob TNF-Inhibitoren womöglich protektiv wirken. Dies scheint eine Netzwerkanalyse zu Malignomen über diverse Indikationen zu suggerieren, wo TNF- versus JAK-Inhibitoren und Placebo ein geringeres Risiko (NMSC ausgenommen) aufwiesen (Risk Ratio, RR -0,60 bzw. -0,31), während JAK-Hemmer fast auf demselben Niveau wie Placebo waren (RR +0,20). In einer versicherungsbasierten japanischen Kohortenstudie waren JAK- gegenüber TNF-Inhibitoren (IRR 1,7) und anderen bDMARDs (IRR 1,2) zwar mit einem höheren Malignomrisiko assoziiert, nicht aber im Vergleich zu Methotrexat (MTX) (IRR 0,8). Zweifel meldete Prof. Dr. Christoph Fiehn, Baden-Baden, an, der darauf hinwies, dass protektive Effekte von Anti-TNF-Therapien im Hinblick auf Malignitäten bislang nicht nachgewiesen werden konnten.
Monitoring unter DMARDs: Wie lange, wer ist zuständig?
Die Maßnahmen bei Therapiebeginn und die Kontrolluntersuchungen variieren bekanntlich je nach Medikation, die den DGRh-Therapieempfehlungen zu entnehmen sind. In puncto MTX ist klinisch eine regelmäßige Befragung und Kontrolle von Exanthem, Stomatitis, gastrointestinalen (GI)-Symptomen, Fieber, Dyspnoe, Husten (Cave: Pneumonitis) und Blutungen angeraten, eine Kontrolle von (Differenzial-)Blutbild, Transaminase- und Nierenwerten soll zu Baseline, initial nach 1-2, dann nach 2-3 und dann alle 4 Wochen erfolgen, bei längerem Verlauf ohne Komplikationen alle 6-12 Wochen. Bei Leflunomid wird eine regelmäßige Kontrolle von Blutdruck, Hautveränderungen, GI-Befunden und Gewichtsabnahme empfohlen (auch auf Polyneuropathie-Symptome sollte geachtet werden), die Frequenz des Verlaufskontrollen ist identisch zu MTX. Im Falle von Hydroxychloroquin (HCQ) sollte in den ersten sechs Monaten eine augenärztliche Basisuntersuchung (GF, OCT) erfolgen, Patienten mit erhöhtem Retinopathie-Risiko sollten jährliche augenärztliche Kontrollen erhalten, solche ohne erst nach 5 Jahren. Eine Kontrolle von CK und LDH wird zu Beginn und dann alle 3-6 Monate empfohlen.
Bei bDMARDs sind zu Beginn der Ausschluss von latenter Tuberkulose (Tb-Test/Rö-Thorax) und Virushepatitis B/C gefragt, Kontraindikationen sind mittels Kreatinin/Harnstoff, Transaminasen und (Differenzial-)Blutbild auszuschließen, auch auf den Impfstatus ist zu achten. Im Verlauf ist bei der klinischen Untersuchung auf Infektzeichen, Abszesse, Fieber, Husten und Kräfteschwund bzw. Gewichtsverlust zu achten. Die Kontrolle von (Differenzial-)Blutbild, Transaminase- und Nierenwerten soll in den ersten drei Monaten monatlich, ab Monat 4 alle 8-12 Wochen erfolgen. Letzteres gilt auch für die JAK-Inhibitoren. Hier ist zusätzlich zu Beginn auf den Lipidstatus zu achten, und insbesondere auf den Impfstatus (vor allem die Herpes Zoster-Impfung). Bei der klinischen Verlaufsuntersuchung stehen vor allem Infekte der oberen Atemwege, Herpes Zoster, Fieber, Diarrhöe und unklarer Gewichtsverlust im Fokus.
Hausärztliche Blutkontrollen unter DMARDs sind tägliche Praxis, laut Fiehn ist die juristische Verantwortung hierbei zu Gunsten der Rheumatologen wirksam delegiert worden. Dies birgt aber Fallstricke in puncto Sicherheit. Er schilderte einen Fall, wo sich ein Hausarzt bei einer älteren RA-Patienten wegen einer mäßigen Anämie unter MTX sorgte. Das Problem war bei nur gering eingeschränkter Nierenfunktion aber eine schwere Leukopenie (als Folge einer Kombination mit Novaminsulfon). Auch die korrekte Interpretation häufiger Phänomene, z. B. einer Neutropenie unter Tocilizumab oder Sarilumab (die aber nicht mit Infektionen assoziiert ist) oder einer persistierenden CK/LDH-Erhöhung unter HCQ (Cave: HCQ-Kardiomyopathie; was ist zu tun?) oder die ausreichende Awareness für seltene Befunde, z. B. einer Eosinophilie unter Sulfasalazin (Cave: DRESS-Syndrom), erfordert fachärztliches Wissen.
Quelle: Session „Sichere Therapie der RA“, 19. September 2025