Aus retrospektiven Kohortenstudien und Registerdaten lässt sich ableiten, dass bei Pso-Patienten die Chance auf eine Prävention oder Verzögerung einer PsA am besten mit Interleukin (IL)-23-Inhibitoren, gefolgt von IL-17- und TNF-Inhibitoren erreichen lässt – eine klare Evidenz aus prospektiven Studien steht aber noch aus. Dasselbe gilt für die Intervention mit Apremilast, IL-17- und IL-12/23-Inhibitoren im Stadium der subklinischen PsA, erläuterte Köhm. Bei etablierter PsA hat sich – dokumentiert in der EULAR- und GRAPPA-Leitlinie – die Auswahl verfügbarer Therapien zuletzt stetig erweitert.
Update zu Deucravacitinib und Sonelokimab
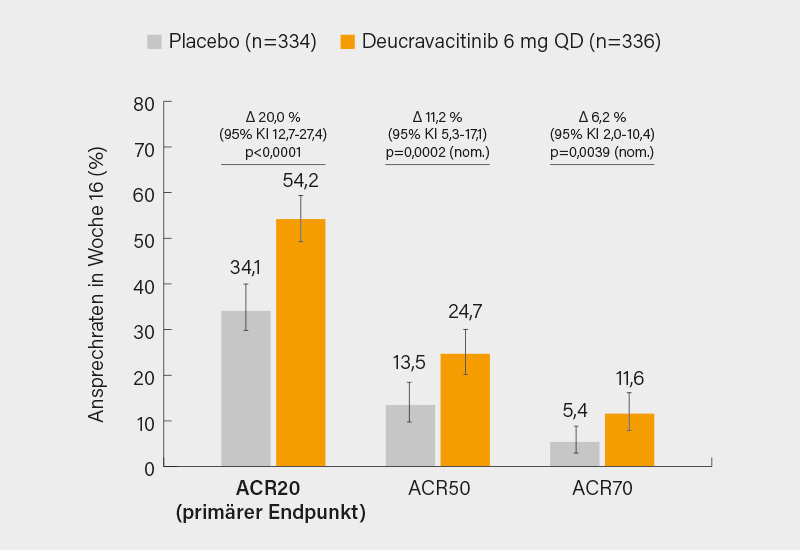
Der nächste Kandidat für eine Zulassung auch bei PsA ist der orale Tyrosinkinase (TYK)-2-Inhibitor Deucravacitinib, der in den beiden Phase-III-Studien POETYK PsA-1 und -2 jeweils den primären Endpunkt erreichte. Auf dem EULAR-Kongress 2025 wurden neben den 52-Wochen-Daten aus POETYK PsA-2 auch erstmals die 16-Wochen-Ergebnisse aus der POETYK PsA-1-Studie, in die bDMAR-naive Patienten mit aktiver PsA und hohem Risiko für eine radiologische Progression eingeschlossen wurden, präsentiert. Mit 54,2 vs. 34,1 % unter Placebo erreichten zu Woche 16 signifikant mehr Patienten mit Deucravactinib den primären Endpunkt eines ACR20-Ansprechens. Auch beim ACR50/70-Ansprechen war Deucravaciitnib signifikant überlegen (Abb.), im Hinblick auf die radiologische Progression war dies nur in einer Post-hoc-Analyse der Fall. Gepoolte Daten beider Studien ergaben ferner signifikante Vorteile in puncto Enthesitis (aber nur im SPARCC) und Daktylitis. Ins Auge springt das bislang vorteilhafte Sicherheitsprofil, so Köhm. Seinen Platz könnte der TYK-2-Inhibitor eher bei moderater PsA vor Biologika finden, auch als Kombinationspartner (z. B. mit Apremilast oder Biologika) könnte er nach Zulassung eine Option sein.
Trotz positiver Phase-II-Daten bei PsA wohl nicht weiterverfolgt wird der niedermolekulare IL-17A-Inhibitor Izokibep, während der bispezifische IL-17A/F-Nanokörper Sonelokimab nach den vorteilhaften Ergebnissen der Phase-II-Studie ARGO derzeit in zwei Phase-III-Studien (IZAR-1 und -2) getestet wird. Von einem Erfolg in Phase-III dürfte auszugehen sein, auch mit einem Blick auf den „herkömmlichen“ dualen IL-17A/F-Inhibitor Bimekizumab, für den laut Köhm inzwischen aus der BE-OPTIMAL-Studie gute 3-Jahres-Langzeitdaten vorliegen, so zum ACR50-Ansprechen (as observed 63,0 %, mNRI 53,2 %), PASI 100-Asnprechen (74,2 bzw. 61,9 %) und Erreichen einer minimalen Krankheitsaktivität (MDA; 64,3 bzw. 52,9 %). Zudem laufen Phase-III-Studien zu dem oral verfügbaren IL-23-Rezeptorinhibitor Icotrokinra.
In schweren Fällen auch Kombinationstherapie möglich
Neu unterschieden wird zwischen einer Complex-to-manage (C2M)- und Difficult-to-treat (D2T)-PsA. Bei der ersten Definition wird das Versagen auf ≥1 b/tsDMARDs im Verbund mit z. B. Komorbiditäten oder Therapiewechseln und der Arzt-/Patienteneinschätzung gefordert, bei der zweiten das Versagen auf ≥3 Therapien (darunter ≥2 verschiedene b/tsMARDs) plus persistierende Symptomatik gemäß Arzt-/Patientenurteil plus anhaltende Entzündung. Für D2T-PsA-Patienten können auch „ungewohnte“ Kombinationen erwogen werden, so Köhm. Beschrieben wurden Fallserien mit der Kombination aus bDMARDs (IL-17- bzw. IL-23-Inhibitoren) und Januskinase (JAK)-Inhibitoren, bDMARDs (IL-17, TNF) und TYK-2-Hemmer sowie häufig bDMARDs (IL-12/23, IL-23, TNF) und Apremilast. Fast durchweg wurde nach 6-12 Monaten eine deutliche Verbesserung der Gelenke (SJC/TJC) und Haut erzielt, dies bei meist guter bzw. akzeptabler Verträglichkeit und nur wenig relevanten Infektionen. Dennoch bedarf es hier natürlich kontrollierter Studien, um valide Aussagen treffen zu können.
Strategien bei früher PsA mit ungünstiger Prognose
Ein Dunkelfeld beleuchtete die SPEED-Studie, in der Patienten mit neu diagnostizierter PsA und ≥1 ungünstigen Prognosefaktoren auf eine csDMARD-Step-up-Standardtherapie, csDMARD-Kombination (Methotrexat [MTX] plus Leflunomid oder Sulfasalazin) oder frühe Anti-TNF-Induktionstherapie (Adalimumab plus MTX für 24 Wochen) randomisiert wurden. Den primären Endpunkt (PASDAS in Woche 24) erreichten signifkant mehr Patienten in der TNF- und csDMARD-Kombinationsgruppe (3,7 bzw. 4,1 vs. 4,7), dies wurde nur mit wenig mehr schweren Nebenwirkungen erkauft. Selbst bei nur 6-monatiger initialer Anti-TNF-Therapie blieben die Vorteile nach einem Jahr bestehen, sodass bei früher, moderater bis schwerer PsA und ungünstiger Prognose ein aggressiverer Therapiebeginn sinnvoll erscheint. Dass im Rahmen von Tight Control und einer Treat-to-target-Strategie bei de-novo PsA eine frühe intensivierte Therapie (First-line Secukinumab plus MTX 15 mg) gegenüber einer Standardtherapie (MTX 25 mg) – jeweils plus 1x 80 mg Methylprednisolon – Vorteile haben kann, belegte die STAMP-Studie. Zwar waren die Ergebnisse nach 12 Monaten vergleichbar, jedoch kam die Secukinumab-Gruppe früher ans Ziel (z. B. ACR50, PASI 90, MDA) und es war seltener eine Therapieeskalation erforderlich.
Quelle: WIN-Session „RA, PsA und axSpA“, 20. September 2025