In der multizentrischen Parallelgruppenstudie ALKIVIA wurde Efgartigimod Ph20 SC (s.c., ko-formuliert mit rekombinanter humaner Hyaluronidase PH20) bei 89 erwachsenen Patienten mit aktiver IIM geprüft (im Mittel 56,6 Jahre, 76,4 % Frauen, mittlere Zeit seit Diagnose 4,4 Jahre). Die Patienten hatten eine Dermatomyositis (DM), immunvermittelte nekrotisierende Myositis (IMNM), Polymyositis (PM) oder ein Antisynthetase-Syndrom (AsyS), zu Baseline wurden 76,4 % mit DMARDs und 82,0 % mit Glukokortikoiden (GK) behandelt. Stratifiziert nach IIM-Subtyp und Krankheitsaktivität wurden die Teilnehmer im Verhältnis 1:1 auf 1x wöchentlich Efgartigimod PH20 SC (n=47) oder Placebo (n=42) randomisiert, jeweils plus Standardtherapie. Primärer Endpunkt war der Total Improvement Score (TIS) gemäß den ACR/EULAR 2016-Kriterien zu Woche 24. Zu den wichtigen sekundären Endpunkten zählten die Zeit bis zum Erreichen eines TIS ≥20/40, der Anteil der Patienten mit einem TIS ≥20/40 sowie Veränderungen im Manual Muscle Testing (MMT)8 und Patienten-/Arzturteil (PGA/MDGA) in Woche 24.
Efgartigimod mit guter Wirksamkeit in Woche 24
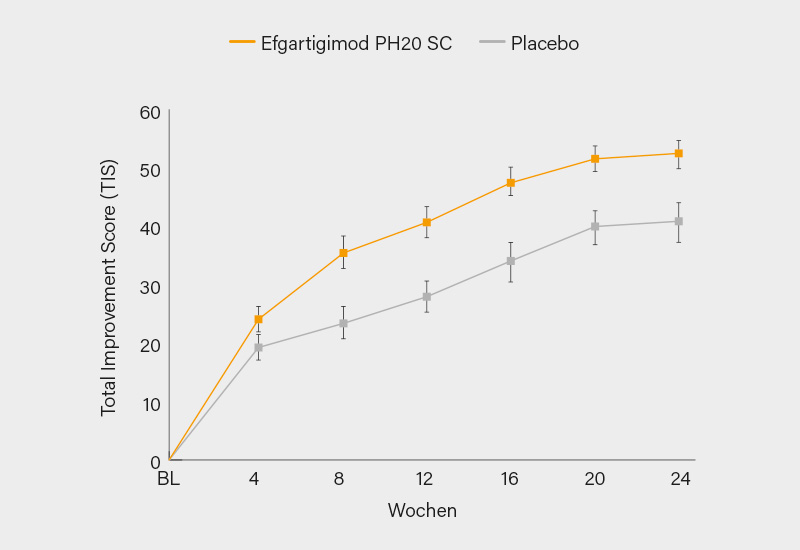
Im Ergebnis war der mittlere TIS in Woche 24 signifikant höher in der Efgartigimod PH20 SC- im Vergleich zur Placebo-Gruppe (50,5 vs. 35,7; p=0,0004) (Abb.). Auch die sekundären Endpunkte wurden erreicht mit Ausnahme einer minimalen klinischen Verbesserung (TIS ≥20) zu Woche 24 (91,5 vs. 73,8 %; p=0,025). Die mediane Zeit bis zu einem TIS ≥20 und ≥40 war signifikant kürzer bei Efgartigimod PH20 SC (30 vs. 71,5 Tage, p=0,0020; und 113 Tage vs. nicht schätzbar, p=0,0293). Ein höherer Anteil an Teilnehmern in der Efgartigimod PH20 SC-Gruppe zeigte eine moderate (TIS ≥40) und signifikante (TIS >60) klinische Verbesserung in Woche 24 im Vergleich zur Placebo-Gruppe (78,7 vs. 47,6 %; p=0,0029, bzw. 34,0 vs. 9,5 %; p=0,0055).
Die Häufigkeit von Nebenwirkungen (UEs) war vergleichbar mit 87,2 % unter Efgartigimod PH20 SC und 88,1 % unter Placebo). Schwere Nebenwirkungen (Grad ≥3) traten bei 14,9 % der Patienten in der Efgartigimod PH20 SC- und bei 28,6 % in der Placebo-Gruppe auf. Ernste Nebenwirkungen traten bei 17 % der Teilnehmer unter Efgartigimod PH20 SC und bei 21,4 % unter Placebo auf. Die häufigsten Nebenwirkungen waren Injektionsstellenerytheme (23,4 %), -Hautausschlag (17,0 %), -Blutergüsse (10,6 %) oder -Reaktionen (10,6 %) sowie Diarrhöe (12,8 %). Infektionen waren bemerkenswert selten. Es gab zwei Todesfälle unter Efgartigimod PH20 SC (beide nicht auf das Studienmedikament zurückzuführen) und keinen unter Placebo.
Fazit
Bei ALKIVIA handelt es sich um die erste Studie eines FcRn-Inhibitors bei IIM. Efgartigimod PH20 SC führte zu signifikanten Verbesserungen im Vergleich zu Placebo bezüglich des TIS und wichtiger sekundärer Endpunkte – dies bei bis dato guter Sicherheit und Verträglichkeit. Die Ergebnisse unterstützen die mechanistische Relevanz der FcRn-Hemmung bei IIM, was auf die potenzielle Pathogenität von Autoantikörpern bei IIM hinweist. Die Ergebnisse stützen die weitere Prüfung von Efgartigimod PH20 SC im laufenden Phase-III-ALKIVIA-Studienprogramm – auch bei Sjögren-Syndrom (hier bereits mit gutem Erfolg) und systemischer Sklerose wird der FcRn-Inhibitor derzeit untersucht.
Quelle: Ann Rheum Dis 2025; 84 (Suppl 1): 2 (OP0002)