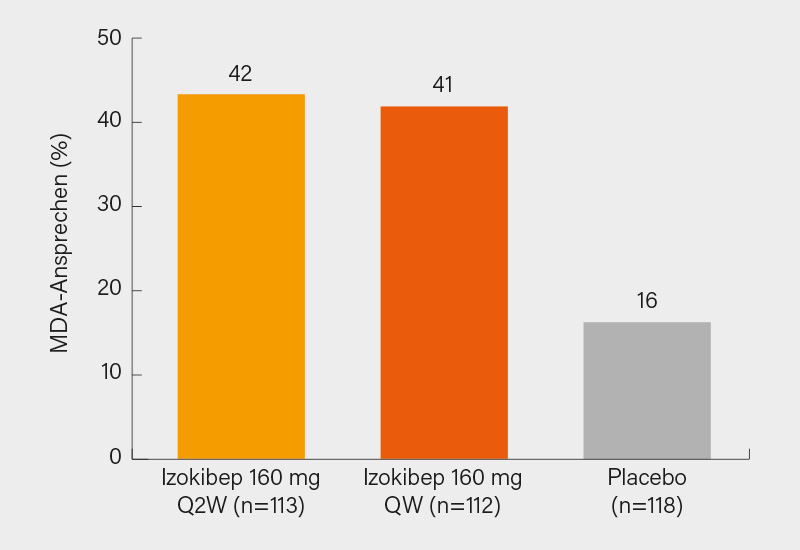
Die 16-Woche-Ergebnisse einer randomisierten, doppelblinden, placebokontrollierten Phase-IIb/III-Studie zu dem IL-17A inhibierenden „small protein“ Izokibep (18,6 kDa) stellten Philip J. Mease, Seattle (USA), und Kollegen als Late-breaker vor. Insgesamt 343 Patienten mit aktiver PsA (≥6 Monate, SJC/TJC ≥3) und unzureichendem Ansprechen oder Intoleranz auf NSAR, csDMARDs oder TNFα-Inhibitoren wurden 1:1:1 auf s.c. Izokibep 160 mg alle 2 Wochen (Q2W) oder 160 mg jede Woche (QW) oder Placebo (QW) randomisiert (im Mittel 51 Jahre, BMI 30, Zeit seit Diagnose 7 Jahre, 53 % Männer, 23 % Anti-TNF-Vortherapie).
Zwei positive Studien zu neuartigen IL-17-Inhibitoren
Der primäre Endpunkt eines ACR50-Ansprechens in Woche 16 wurde sowohl mit Izokibep Q2W als auch QW versus Placebo erreicht (43 bzw. 40 % vs. 15 %; p<0,0001) mit starkem Wirkeintritt ab Woche 4. Signifikante Vorteile zeigten sich auch in sekundären Endpunkten wie dem ACR70-Kriterium (23 bzw. 25 % vs. 5 %; p<0,0001), PASI 100-Ansprechen (47 bzw. 51 % vs. 12 %; p<0,0001) und Erreichen einer minimalen Krankheitsaktivität (MDA) in Woche 16 (42 bzw. 41 % vs. 14 %; p<0,0001) (Abb. 1). Mehr Patienten erreichten auch eine minimal klinisch bedeutsame Verbesserung (≥0,35) im HAQ-DI (50 bzw. 47 % vs. 37 %) und z. T. eine vollständige Resolution der Enthesitis (LEI =0) (56 bzw. 45 vs. 47 %). Bei hoher Enthesitis-Last zu Studienbeginn (LEI = 5-6) fiel das Ergebnis eindeutiger zugunsten von Izokibep aus. Therapieassoziierte unerwünschte Ereignisse (TEAEs) traten bei 66 bzw. 72 % vs. 41 % der Patienten auf, am häufigsten waren meist milde bis mäßige Reaktionen an der Einstichstelle, die nur selten zum Abbruch der Therapie führten (1 bzw. 4 % vs. 0 %). Es gab keine Todesfälle, schwere AEs waren mit 2 bzw. 3 % vs. 1 % selten, ebenso Colitis ulcerosa und Candidiasis (je max. 1 %). Izokibep zeigte somit bei guter Verträglichkeit ein schnelles Ansprechen über viele PsA-Manifestationen hinweg, dies vor allem auch bei anspruchsvollen Endpunkten, von einer späteren Zulassung dürfte wohl auszugehen sein. (1)
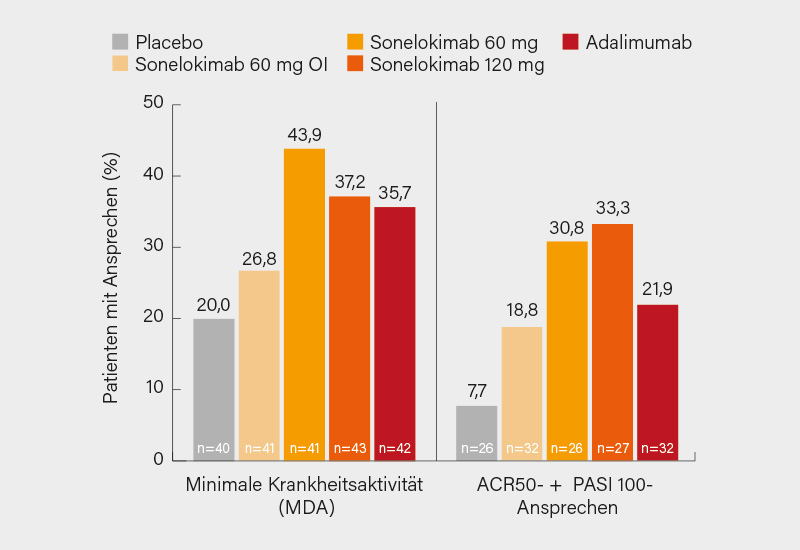
Ähnlich wie Bimekizumab setzt auch Sonelokimab an IL-17A und F an, dies aber in Form eines Nanokörpers (ca. 40 kDa). Über dessen Ergebnisse in der globalen, randomisierten, doppelblinden, placebokontrollierten Phase-II-Studie ARGO berichtete stellvertretend Iain B. McInnes, Glasgow (Großbritannien). In der 24-wöchigen Studie wurden 207 Patienten mit aktiver PsA (SJC/TJC ≥3) und Psoriasis (69 % mit ≥3 % KOF) im Verhältnis 1:1:1:1:1 auf Sonelokimab 120 mg Q4W (mit Induktion Q2W bis Woche 8), 60 mg Q4W (mit Induktion), 60 mg Q4W (ohne Induktion [OI]), Placebo oder Adalimumab 40 mg Q2W als Referenz randomisiert (49 % Frauen, im Mittel 49 Jahre, BMI 29, Krankheitsdauer 5,4 Jahre, 17 % bDMARD-erfahren) – die Abbruchrate betrug insgesamt ca. 4 %.
Der primäre Endpunkt eines ACR50-Ansprechens in Woche 12 wurde mit Sonelokimab 120 mg oder 60 mg signifikant erreicht (46,5 %; p=0,009 bzw. 46,3 %; p=0,012, 60 mg OI 36,6 %; p=0,086, Placebo 20,0 %). Dies galt auch für wichtige sekundäre Endpunkte wie den ACR20 (120 mg 72,1 %; p=0,002, 60 mg 78,0 %; p<0,001, 60 mg OI 75,6 %; nominal p<0,001 vs. Placebo 37,5 %), PASI 90 (120 mg 59,3 %; p=0,003, 60 mg 76,9 %; p<0,001, 60 mg OI 50,0 %; nominal p=0,009 vs. Placebo 15,4 %) – ein signifikantes Ansprechen wurde ab Woche 4 verzeichnet. Zu Woche 12 erreichten ca. 40 % der Patienten eine MDA (60 mg 43,9 %; nominal p=0,022 vs. Placebo 20,0 %) (Abb. 2) und >30 % unter Sonelokimab 120 und 60 mg den Komposit aus ACR50 und PASI 100 – dies begleitet von einer verbesserten Lebensqualität z. B. im PsAID-12. Sonelokimab wurde gut vertragen ohne unerwartete Sicherheitssignale, es traten weder Fälle von CED noch schwere kardiovaskuläre Ereignisse (MACE) auf, nur zwei Fälle einer leichten bis mäßigen oralen Candidiasis (1,6 %). (2) Angesichts dieser positiven Daten wurden bereits zwei Phase-III-Studien namens IZAR-1 und -2 mit 1.500 Patienten zur weiteren Evaluation von Sonelokimab bei PsA angekündigt.
Erste Phase-II-Daten zu neuem TYK-2-Inhibitor
Auch wenn die Daten zum oralen TYK-2-Inhibitor Zasocitinib (TAK-279) bereits beim ACR 2023 gezeigt wurden, sei erneut auf die von Alan Kivitz, Duncansville (USA), und Kollegen präsentierten Ergebnisse einer randomisierten, doppeblinden, placebokontrolllierten Phase-IIb-Studie eingegangen. In dieser wurden 290 Patienten mit aktiver PsA trotz NSAR, cs- oder bDMARD-Vortherapie (Symptome ≥6 Monate, SJC/TJC ≥3) im Verhältnis 1:1:1:1 für 12 Wochen auf 1x täglich Zasocitinib 5 mg (n=71), 15 mg (n=75), 30 mg oder Placebo (jeweils n=72) randomisiert. 245 schlossen die Studie ab (58,6 % mit Psoriasis ≥3 %
KOF, PASI zu Baseline 6,2; 32,1 % bDMARD-erfahren 20,7 %).
Der primäre Endpunkt eines ACR20-Ansprechens in Woche 12 wurde mit Zasocitinib 15 mg und 30 mg erreicht (53,3 und 54,2 vs. 29,2 %; je p=0,002). Dasselbe galt für das ACR50-Ansprechen (26,7 und 26,4 vs. 15,5 %; p=0,005 bzw. p=0,009). Das PASI 75-Ansprechen war am höchsten unter der 30 mg-Dosis (45,7 %) und signifikant besser versus Placebo (15,4 %; p=0,002), eine MDA erreichten mit 15 und 30 mg je knapp 30 % der Teilnehmer. Bei guter Verträglichkeit fanden sich TEAE unter der 30 mg-Dosis häufiger (40,3 vs. 15,3 %), zum Abbruch führten sie selten (6,9 %). Schwere TEAE (opportunistische Infektionen oder MACE) blieben aus. (3) Eine Phase-III-Studie ist geplant, die Ergebnisse einer solchen zu Deucravacitinib, dem ersten in dieser Indikation getesteten TYK-2-Inhibitor, sollten demnächst vorliegen.
Strategiestudie bei früher PsA und Transition zur PsA
Mit der Frage, ob sich der Übergang von der Psoriasis (PsO) zur PsA durch den Einsatz von bDMARDs verhindern lässt, beschäftigten sich spanische Experten um Beatriz Joven-Ibáñez, Madrid, in einer globalen, retrospektiven Bevölkerungsstudie unter Nutzung der elektronischen TriNetX-Datenbank mit über 1 Mio. PsO-Patienten, davon 869.000 ohne PsA, die neu mit TNFα-, IL-12/23-, IL-23- und IL-17-Inhibitoren (n=23.610, n=5.820, n=5.270 bzw. n=5.640) behandelt wurden. Nach Adjustierung mittels Propensity Score-Matching war nach 5 Jahren das Risiko für die Entwicklung einer PsA relativ zu TNFα-Inhibitoren in der Erstlinie 37 bzw. 39 % geringer unter IL12/23- bzw. IL-23-Inhibitoren, dies traf abgeschwächt nach 3 Jahren auch auf deren Einsatz in der Zweitlinie vs. Erstlinien-Anti-TNF zu (-32 bzw. -31 %). IL-23-Inhibitoren waren in der Erst- und Zweitlinie mit einem nach 5 und 3 Jahren 47 % geringeren PsA-Risiko als IL-17-Inhibitoren assoziiert. Dennoch sollten die Daten nicht überinterpretiert werden, auch wenn IL-23 (vs. IL-17 oder TNFα) in der Erst- und Zweitlinie das wichtigste Zielmolekül bei PsO zu sein scheint. (4)
Von großem Interesse war die von Gabriele De Marco, Leeds (Großbritannien), und Kollegen vorgestellte 52-wöchige randomisierte, doppelblinde, placebokontrollierte GOLMePsA-Studie, in der 84 Patienten mit früher, therapienaiver PsA (≤24 Monate, SJC/TJC ≥3 oder ≥2 plus eine druckschmerzhafte Enthese) ausgehend von MTX 15 mg/Woche (und einem Methylprednisolon-Bolus 120 mg i.m.) zusätzlich auf s.c. Golimumab 50 mg Q4W oder Placebo randomisiert wurden. In beiden Armen wurde MTX bis Woche 4 auf bis zu 25 mg/Woche hochtitriert (weitere i.a./i.m.-Steroidgaben waren in Woche 8 und 12 gestattet). In Woche 24 wurden Golimumab/Placebo gestoppt und MTX 25 mg/Woche weitergeführt, falls toleriert (andere Therapien waren nach Ermessen erlaubt). Im primären Endpunkt, dem PASDAS-Score in Woche 24, zeigte sich kein signifikanter Vorteil des bDMARDs (mittlere adjustierte Differenz -0,55; p=0,064). Dasselbe traf unter MTX allein vs. plus Golimumab auf das ACR20-Ansprechen (65,9 vs. 65,1 %; p=0,939) und Erreichen einer MDA zu (58,5 vs. 55,8 %; p=0,802). Mehr Patienten unter der MTX-Monotherapie erhielten i.a./i.m.-Steroide (48,8 vs. 20,9 %; p=0,009). In Woche 52 schnitt die MTX-Monotherapie bei hoher Retention (63 %) immer noch sehr gut ab (ACR20 75,7 %, MDA 54,1 %). Für viele Patienten scheint somit ein direkter Einstieg mit einem bDMARD nicht erforderlich zu sein, MTX allein (aber mehr Steroide!) war überraschend effektiv und gut verträglich. (5)
Quellen:
1 Ann Rheum Dis 2024; 83 (Suppl1): 235 (LBA0005)
2 Ann Rheum Dis 2024; 83 (Suppl1): 154 (OP0195)
3 Ann Rheum Dis 2024; 83 (Suppl1): 149 (OP0138)
4 Ann Rheum Dis 2024; 83 (Suppl1): 168 (OP0010)
5 Ann Rheum Dis 2024; 83 (Suppl1): 153 (OP0184)