Die letzten EULAR-Empfehlungen zum Management des SLE stammen aus 2023 und waren damit sicher noch nicht veraltet. (1) Da sich aber gerade im Hinblick auf die Behandlung der LN einige Neuerungen ergeben, die auch noch in diesem Jahr in die Versorgung kommen werden, lag eine Aktualisierung nahe. Eine neue ACR-Guideline für das Management der LN wurde kürzlich online publiziert. (2) Nicht unerwähnt bleiben soll an dieser Stelle auch die neue Leitlinie zum Management des SLE der DGRh (3), die demnächst in der Zeitschrift für Rheumatologie erscheinen wird.
EULAR-Empfehlungen zum LN-Management
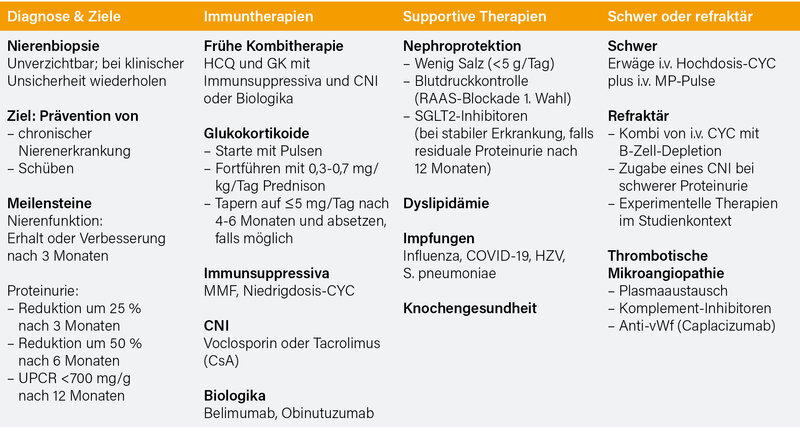
Auf dem EULAR-Meeting wurde nun von Dimitrios Boumpas das Update 2025 der Empfehlungen zur Behandlung der Lupus-Nephritis vorgestellt. (4) Die vier Übergeordneten Prinzipien („Overarching Principles“) werden nachfolgend aufgeführt: Bei SLE-Patienten sind eine regelmäßige Überwachung auf Anzeichen und Symptome einer Nierenbeteiligung, die Beratung durch Experten und eine rechtzeitige Biopsie von entscheidender Bedeutung, um optimale Ergebnisse zu erzielen. Die Behandlung von SLE-Patienten mit Nierenbeteiligung sollte sich an den allgemeinen Empfehlungen für SLE orientieren, einschließlich der Behandlung mit Hydroxychloroquin. Eine Nierenbeteiligung bei SLE birgt das Risiko einer fortschreitenden chronischen Nierenerkrankung und wird am besten durch gemeinsame, informierte Entscheidungen von Patienten und Ärzten durch interdisziplinäre rheumatologisch-nephrologische Behandlungsteams mit regelmäßiger Bewertung der Risikofaktoren für das Fortschreiten der chronischen Nierenerkrankung behandelt. Die Behandlung zielt darauf ab, das Fortschreiten der chronischen Nierenerkrankung und Krankheitsschübe zu verhindern, Komorbiditäten zu behandeln und die gesundheitsbezogene Lebensqualität zu verbessern; sowohl die immunsuppressive Therapie als auch die nicht-immunologische Therapie, einschließlich der Nephroprotektion, sind wesentlich.
EMPFEHLUNG 1: Wann sollte eine Nierenbiopsie durchgeführt werden?
Eine Nierenbiopsie wird bei jedem Patienten mit Anzeichen einer Nierenbeteiligung empfohlen, insbesondere bei Patienten mit anhaltender Proteinurie (≥0,5 g/24 h oder Urin-Protein-Kreatinin-Ratio [UPCR] ≥500 mg/g) und/oder glomerulärer Hämaturie und/oder ungeklärter Abnahme der glomerulären Filtrationsrate.
EMPFEHLUNG 2: Behandlungsziele
Als Behandlungsziele werden der Erhalt der Nierenfunktion (Erhalt oder Verbesserung bis zum 3. Monat der Behandlung) und die Reduktion der Proteinurie genannt. Hier soll eine Reduktion der Proteinurie um ≥25 % nach 3 Monaten, um ≥50 % nach 6 Monaten und nach 12–24 Monaten soll die Eiweißausscheidung unter 0,5–0,7 g/Tag liegen.
EMPFEHLUNG 3: Therapie mit Glukokortikoiden
Bei aktiver LN wird zu Beginn eine i.v. Pulstherapie mit Methylprednisolon (in den bisherigen Empfehlungen 250–1.000 mg) für bis zu 3 Tage empfohlen, gefolgt von Predniso(lo)n mit 0,3–0,7 mg/kg/Tag p.o. Glukokortikoide (GK) sollen innerhalb von 4-6 Monaten auf eine Tagesdosis von ≤5 mg reduziert und bei anhaltender kompletter renaler Remission dann langsam ganz abgesetzt werden.
EMPFEHLUNG 4: Standard-Immunsuppression
Bei Patienten mit aktiver LN, insbesondere bei Patienten mit schlechten Prognosefaktoren, wird eine Kombinationstherapie empfohlen, bestehend aus:
- Mycophenolat (Zieldosis 2-3 g/Tag) oder niedrig-dosiert i.v. Cyclophosphamid (CYC; Euro-Lupus-Protokoll mit 6x 500 mg in 14-tägigem Abstand) in Kombination mit Belimumab oder
- Mycophenolat in Kombination mit einem Calcineurin-Inhibitor (CNI; Voclosporin oder Tacrolimus) oder
- Mycophenolat in Kombination mit Obinutuzumab.
Die Monotherapie mit Mycophenolat oder niedrig-dosiertem CYC wird (noch) als alternatives Schema aufgeführt.
EMPFEHLUNG 5: Eskalierte Immunsuppression
Bei Patienten mit rapid-progressiver LN kann eine kurze Serie (6-7 monatliche Pulse mit 10 bis 15 mg/kg) einer höher dosierten i.v. CYC-Therapie erwogen werden.
EMPFEHLUNG 6: Immunsuppression zum Remissionserhalt
Nach dem renalen Ansprechen sollte die Behandlung für mindestens drei Jahre fortgesetzt werden. Patienten, die ursprünglich mit Mycophenolat allein oder in Kombination mit i) Belimumab oder ii) einem CNI oder iii) Obinutuzumab behandelt wurden, sollten diese Medikamente weiter erhalten. Azathioprin oder Mycophenolat sollten bei den Patienten eingesetzt werden, die ursprünglich mit CYC allein oder in Kombination mit Belimumab behandelt wurden.
EMPFEHLUNG 7: Deeskalation
Bei Patienten in anhaltender Remission sollte eine schrittweise Reduktion der immunsuppressiven und/oder biologischen Therapie drei Jahre nach dem Ansprechen erwogen werden, wobei das Risiko eines Rezidivs immer zu berücksichtigen ist.
EMPFEHLUNG 8: Anhaltende Krankheitsaktivität
Bei Patienten mit anhaltender Krankheitsaktivität (oder „relapsing disease“) wird ein Wechsel unter den genannten Immunsuppressiva und/oder Biologika sowie eine Überweisung zu einem Experten empfohlen.
EMPFEHLUNG 9: Bedeutung einer erneuten Nieren-PE
Eine erneute Nierenbiopsie sollte bei klinischer Unsicherheit in Erwägung gezogen werden, um das Ansprechen auf die Behandlung, die Verschlechterung nierenspezifischer Labortests oder das geplante Absetzen der immunsuppressiven Behandlung besser beurteilen zu können. Vom präsentierenden Autor, D. Boumpas, wurde das als „sehr selten notwendig“ eingestuft.
EMPFEHLUNG 10: Nephroprotektion und supportive Therapien
Zur Nephroprotektion wird eine salzarme (<5 g/Tag) Ernährung, eine rigide Blutdruckkontrolle (1. Wahl: RAAS-Blocker) und SGLT-2-Inhibitoren empfohlen. Zusätzlich werden Statine zur Cholesterinsenkung und eine Beachtung der „Knochengesundheit“ empfohlen.
EMPFEHLUNG 11: Thrombotische Mikroangiopathie (TMA)
Bei Patienten mit Zeichen einer TMA (Antiphospholipidsyndrom-Nephropathie, zu große Lücke thrombotisch-thrombozytopenische Purpura oder atypisches hämolytisch-urämisches Syndrom) sollten GK (i.v. Methylprednisolon), Komplementinhibitoren, B-Zell-depletierende Therapien, Caplacizumab, Plasmapherese und/oder Antikoagulation in Betracht gezogen werden.
Was ist neu an den 2025 EULAR-Empfehlungen zum LN-Management?
In den neuen EULAR-Recommendations (Zusammenfassung siehe Tab. 1) werden, wie auch schon in den letzten nationalen (DGRh 2025) und internationalen (EULAR 2023, ACR 2024) Empfehlungen weniger GK, vor allem in der peroralen Therapie empfohlen, zudem mit einer definierten und relativ raschen Reduktion. Die Bedeutung der Kombinationstherapie von Mycophenolat oder i.v. CYC mit Belimumab oder einem CNI gegenüber der Monotherapie wird betont. Eine Unterscheidung zwischen den proliferativen Lupusnephritiden (Typ III und IV) und der rein membranösen Form (Typ V) erfolgt nicht mehr. Das ist angesichts der Art und Schwere der LN bei diesen Typen zunächst verwunderlich, in der einfachen „Standard-Immunsuppression“ ist die Behandlung – wenn erforderlich – allerdings wirklich dieselbe. Zudem ist die rein membranöse Glomerulonephritis eine eher seltene Form der LN. Es wird auch keine Stratifizierung nach Subgruppen (z. B. große Proteinurie, extrarenale Aktivität) vorgenommen. In den ACR-Guidelines wird z. B. bei deutlicher Proteinurie eher ein CNI empfohlen, während bei zusätzlicher extrarenaler Krankheitsaktivität die Kombination mit Belimumab bevorzugt wird. Ob hierauf in den erklärenden Texten der neuen EULAR-Recommendations noch eingegangen wird, kann man erst beurteilen, wenn die schriftliche Publikation vorliegt.
Neu ist vor allem die Empfehlung zum Einsatz von Obinutuzumab zur Remissionsinduktion. Der dieser Empfehlung zugrundeliegende REGENCY-Trial wird im nächsten Kapitel vorgestellt. Die Empfehlung, diese Anti-B-Zelltherapie auch schon in der Erhaltungstherapie einzusetzen, entbehrt allerdings noch jeglicher Studiendaten. Der Studienarm mit Fortführung von Obinutuzumab in der Langzeittherapie ist noch gar nicht abgeschlossen.
Anti-B-Zelltherapie mit Obinutuzumab
Obinutuzumab ist ein humanisierter monoklonaler Antikörper, der nicht nur deshalb als „Rituximab 2.0“ bezeichnet werden kann, weil er mit dem B-Zelloberflächenmarker CD20 dasselbe Zielantigen wie dieses adressiert, sondern auch bereits für dieselben hämatologischen Indikationen (chronisch-lymphatische Leukämie, follikuläres Lymphom) zugelassen ist. Im Vergleich zu Rituximab weist Obinutuzumab eine deutlich höhere Affinität zum CD20 auf, was eine verstärkte B-Zell-Depletion zur Folge hat und damit eine klinisch deutlich bessere Wirksamkeit in den bisher zugelassenen hämatologischen Indikationen.
In der REGENCY-Studie wurde der Einsatz von Obinutuzumab bei aktiver LN untersucht. (5) In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie erhielten 271 Patienten mit aktiver proliferativer LN (ISN/RPS Klasse III oder IV, mit/ohne Klasse V) zusätzlich zur Standardtherapie (Mycophenolat-Mofetil + GK) entweder Obinutuzumab (zweimal 1 g i.v. im Abstand von 14 Tagen mit Wiederholung nach einem halben und einem Jahr) oder Placebo-Infusionen. Primärer Endpunkt war eine komplette renale Remission (CRR mit UPCR <0,5 g/g, eGFR ≥85 % des Ausgangswertes und keine interkurrenten Verschlechterungen wie Therapieversagen, Notwendigkeit einer Salvage-Therapie, Tod oder vorzeitiger Studienabbruch) zu Woche 76.
Der primäre Endpunkt einer CRR nach 76 Wochen wurde in der Obinutuzumab-Gruppe mit 46,4 % signifikant häufiger erreicht als in der Placebo-Gruppe mit 33,1 % (p=0,0232). Eine CRR mit erfolgreicher Prednison-Reduktion wurde unter Obinutuzumab in 42,7 % der Fälle erreicht, unter Placebo in 30,9 %, eine UPCR <0,8 g/g in 55,5 % gegenüber 41,9 %. In der Safety-Analyse ergaben sich – abgesehen von der Problematik, dass die Studie zu Pandemiezeiten erfolgte und mehrere COVID-19-Todesfälle in Süd- und Mittelamerika zu beklagen waren – keine neuen Sicherheitssignale. Diese Ergebnisse gaben Anlass sowohl bei der FDA als auch der EMA einen Antrag auf Zulassung von Obinutuzumab zur Behandlung der Lupus-Nephritis zu stellen. Es wird noch in diesem Jahr mit einem positiven Votum der Zulassungsbehörden gerechnet. In Form eines Posters wurde auch über die erfolgreiche Behandlung mit Obinutuzumab von 9 zuvor auf Rituximab und CYC refraktäre Lupuspatientinnen berichtet. (6)
Neues zu CAR-T-Zellen und T-Zell-Engagern
Wie auf allen Kongressen in der letzten Zeit wurde auch wieder viel über die Therapie mit CD19-CAR-T-Zellen berichtet. Neue Herstellungsformen von CAR-T-Zellen, neue Zielantigene, die sog. Compound- oder dual-targeting CAR-T-Zellen oder die Möglichkeit allogener CAR-T-Zellen (die man quasi „auf Halde“ produzieren kann) lassen hier weitere spannende Entwicklungen erkennen, welche den zeitlichen und logistischen Aufwand dieser immer noch experimentellen Therapie verringern, die Verfügbarkeit erleichtern und perspektivisch sicher auch die Kosten senken dürften. Spannend ist aber vor allem eine Steigerung der Wirksamkeit mit dual-targeting CD19/BCMA CARs sowie monoklonalen Antikörperkonstrukten, welche zwei oder inzwischen sogar drei Bindungsstellen aufweisen (bi- und tri-spezifische T-Zell-Engager) und so – ähnlich wie CAR-T-Zellen – körpereigene zelluläre Abwehrmechanismen nutzen, um schwere Autoimmunerkrankungen zu behandeln.
Als Beispiele seien erwähnt der Einsatz von CD19/BCMA Dual-Targeting FasTCAR-T-Zellen bei 10 SLE-Patientinnen aus China (7), der erfolgreiche Einsatz des bi-spezifischen CD19xCD3 T-Zell-Engagers Blinatumomab bei inzwischen 3 Patienten mit schwerer systemischer Sklerose in der Rheumatologie der LMU München (8) und der Einsatz eines tri-spezifischen CD19xCD3xCD28 T-Zell-Engagers, der also auch noch die Co-Stimulation über CD28 als zweite Bindungsstelle zwischen autologer zytotoxischer T-Zelle und B-Zelle nutzt, bei 5 SLE-Patientinnen aus China. (9)
Efgartigimod bei Myositiden
Efgartigimod ist ein für die Behandlung der schweren (ACh-Rezeptor-Antikörper-positiven) Myasthenia gravis zugelassenes Biologikum, welches den (Ag-unspezifischen) Fc-Teil von Immunglobulin G (IgG) enthält, mit hoher Affinität zum sog. neonatalen Fc-Receptor (FcRn), welcher auf Endothelzellen und Plazentazellen für den aktiven Transport von IgG verantwortlich ist. Durch Blockade dieser FcRn-Rezeptoren konkurriert Efgartigimod mit normalen IgG-Molekülen um das physiologische „Recycling“ der Immunglobuline, was zu einem raschen Abfall der IgG-Serumspiegel führt und damit auch von pathogenetischen Autoantikörpern („in-vivo Immunadsorption“). Zu den häufigsten Nebenwirkungen zählen Kopfschmerzen und Infektionen der oberen Atemwege sowie Harnwegsinfekte.
Hector Chinoy aus Manchester berichtete nun über eine randomisierte, placebokontrollierte Studie zum Einsatz von Efgartigimod (1 g s.c. einmal pro Woche) bei 89 Patienten mit idiopathischer inflammatorischer Myopathie (IIM) über 24 Wochen. (10) Es zeigte sich ein signifikantes Ansprechen in einem Komposit-Score (TIS) ab der 4. Behandlungswoche. Erwartungsgemäß registrierte man einen drastischen Abfall der IgG-Spiegel um durchschnittlich 72 %, der aber nicht von einer vermehrten Infektneigung gegenüber der Placebogruppe begleitet war.
Nerandomilast bei autoimmunen ILD
Nerandomilast ist ein peroral verabreichter Inhibitor der Phosphodiesterase (PDE) 4B mit antifibrotischen und immunmodulatorischen Eigenschaften. In der FIBRONEER-ILD-Studie wurde Nerandomilast bei progredienter Lungenfibrose (PPF) untersucht. (11) Insgesamt erhielten 1.178 Patienten über mindestens 52 Wochen Nerandomilast 9 mg oder 18 mg zweimal täglich oder Placebo. Primärer Endpunkt war die Veränderung der forcierten Vitalkapazität (FVC) nach 52 Wochen, welche unter Placebo um durchschnittlich 165,8 ml abnahm, unter Nerandomilast 9 mg um 84,6 ml und unter Nerandomilast 18 mg um 98,6 ml. Beide Dosierungen zeigten somit eine signifikante Verlangsamung des FVC-Verlusts - wie bei den Nintedanib-Studien. Ähnlich zum Nintedanib waren auch die unerwünschten Effekte mit hauptsächlich Diarrhöen.
Eine Subanalyse der 325 Patienten mit einer PPF im Rahmen einer autoimmunen interstitiellen Lungenerkrankung (AI-ILD; 28 % der Gesamtpopulation) wurde auf dem EULAR als Late-breaking Abstract von Anna-Maria Hoffmann-Vold vorgestellt. (12) Hier zeigte sich eine gegenüber der Gesamtgruppe etwas geringere Verlangsamung der FVC-Abnahme mit 61,2 ml unter 9 mg und 64,9 ml unter 18 mg Nerandomilast gegenüber Placebo mit 107,1 ml. Dies kann gut durch die begleitende antiinflammatorische Therapie erklärt werden, welche in der Gruppe der AI-ILD natürlich häufiger erfolgte als in der Gesamtpopulation. Eine zusätzliche Therapie mit Nintedanib erhielten übrigens (zu Studienbeginn) 44 % aller und 34 % der AI-ILD Patienten.
Bei Patienten mit AI-ILD und PPF zeigte sich Nerandomilast in der Verlangsamung des Rückgangs der FVC ähnlich wirksam wie in der Gesamtpopulation. Nerandomilast wies auch einen numerischen Vorteil in Bezug auf das Risiko einer akuten Exazerbation, einer Hospitalisierung oder Tod auf. Die häufigste unerwünschte Nebenwirkung im Zusammenhang mit Nerandomilast waren Diarrhöen. Der PDE-4B-Inhibitor könnte somit eine neue Therapieoption für Patienten mit progressiver Lungenfibrose darstellen und eine Zulassung für die Behandlung der PPF – wohl auch bei AI-ILD – kann erwartet werden. Unklar ist aber, wie diese im Hinblick auf eine gleichzeitige antifibrotische Therapie mit Nintedanib formuliert wird und bei AI-ILD bei gleichzeitiger Immunsuppression. Hierzu bedarf es sicher noch genauer Subgruppenanalysen, es ist z. B. nicht klar, wie häufig Nintedanib im Verlauf beendet wurde (die Prozentraten der gleichzeitigen Therapie bezogen sich nur auf den Studienbeginn). Auffälligerweise war die Abnahme der FVC in der Placebogruppe, also ohne Einnahme von Nerandomilast, unter Therapie mit Nintedanib höher (181 ml) als ohne eine solche (154 ml). Dies wurde von den Autoren damit erklärt, dass die in der Studie zugelassene, aber nicht randomisierte zusätzliche Gabe von Nintedanib bei Patienten erfolgte, deren PPF tendenziell schwerer ausgeprägt war.
Fazit
Die EULAR 2025 hat eindrucksvoll gezeigt, wie dynamisch sich die Therapie von Kollagenosen und insbesondere der Lupus-Nephritis weiterentwickelt. Die neuen Empfehlungen setzen auf individualisierte Kombinationstherapien, frühzeitige Diagnostik und interdisziplinäre Betreuung. Biologika, zielgerichtete Immunmodulatoren und zellbasierte Therapien eröffnen neue Perspektiven mit dem Ziel, das Fortschreiten von Organbeteiligungen zu verhindern und die Lebensqualität der Betroffenen nachhaltig zu verbessern.
Zunehmend werden neue immunologische Therapien, wie CAR-T-Zellen und T-Zell-Engager auch bei anderen, schwer verlaufenden Kollagenosen eingesetzt. Hiermit scheint man deutlich näher an der ursächlichen Störung, welche zur Autoimmunität führt, anzugreifen und gewissermaßen einen Reset des Immunsystems zu bewirken. Ein besseres Verständnis der damit einhergehenden Risiken erlaubt auch eine bessere Prophylaxe, z. B. durch die Substitution eines therapiebedingten Mangels an Immunglobulinen oder durch Interleukin-6-Rezeptorinhibitoren bei therapiebedingtem Cytokin-Release-Syndrom.
Prof. Dr. med. Christof Specker
Klinik für Rheumatologie & Klinische Immunologie
Evangelisches Krankenhaus
Pattbergstraße 1-3, 45239 Essen
Literatur: 1 Fanouriakis A et al., Ann Rheum Dis 2024; 83(1): 15-29 | 2 Sammaritano LR et al., Arthritis Rheumatol 2025; doi: 10.1002/art.43212 | 3 Deutsche Gesellschaft für Rheumatologie und Klinische Immunologie e. V. S3 Leitlinie zum Management des systemischen Lupus erythematodes Version 1.1 Link: register.awmf.org/de/leitlinien/detail/060-008. Zugriff am: 15.07.2025 | 4 Boumpas D. 2025 EULAR Recommendations for the Management of SLE with kidney involvement. EULAR 2025 Sitzung Recommendations I, 13.06.2025 | 5 Furie RA et al., N Engl J Med 2025; 392(15): 1471-1483 | 6 Leandro M et al., Ann Rheum Dis 2025; 84 (Suppl 1): 1294 (POS1238) | 7 Qiong F et al., Ann Rheum Dis 2025; 84 (Suppl 1): 65 (OP0074) | 8 Gebhardt C et al., Ann Rheum Dis 2025; 84 (Suppl 1): 1197 (POS1113) | 9 Yingfeng H et al., Ann Rheum Dis 2025; 84 (Suppl 1): 319 (LB0007), 1111 (POS0998), 1318 (POS1267) | 10 Chinoy H et al., Ann Rheum Dis 2025; 84 (Suppl 1): 2 (OP0002) | 11 Maher TM et al., N Engl J Med 2025; 392(22): 2203-2214 | 12 Hoffmann-Vold AM et al., Ann Rheum Dis 2025; 84 (Suppl 1): 315 (LB0003)