Zunächst zu Enpatoran, einem neuartigen, oralen, niedermolekularen TLR7/8-Inhibitor, der in der randomisierten, doppelblinden, placebokontrollierten, adaptiven Phase-II-Parallelstudie WILLOW bei Patienten mit SLE oder kutanem Lupus (CLE) on top einer Standardtherapie (SoC) geprüft wurde. In der zuvor beim Lupus 2025-Kongress in Toronto präsentierten Kohorte A hatte Enpatoran eine signifikante Dosis-Wirkungs-Beziehung in der Veränderung CLASI-A-Scores gegenüber Placebo in Woche 16 bei CLE- (oder SLE-)Patienten mit aktivem Lupus-Ausschlag gezeigt. Über die Kohorte B zu Patienten mit aktivem SLE trotz SoC berichtete für die internationale Studiengruppe Eric Morand, Melbourne (Australien).
TLR7/8-Inhibition mit Enpatoran im Fokus
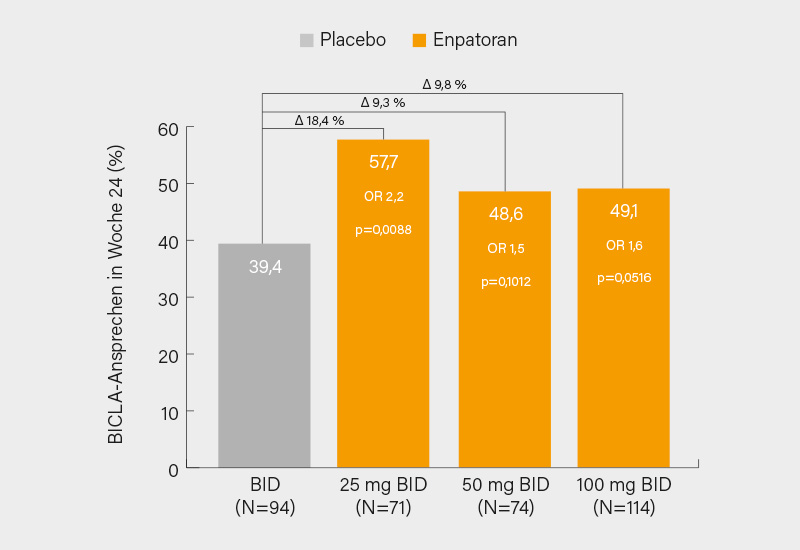
In die Studie wurden 353 Patienten mit mäßig bis hoch aktivem SLE (BILAG 2004 ≥1A oder 2B und hybridem SELENA-SLEDAI ≥6 und/oder CLASI-A ≥8) eingeschlossen (95 % Frauen, median 41 Jahre, 85 % auf Glukokortikoiden [GK], davon 51 % mit Dosis ≥10 mg/Tag). In Teil 1 erfolgte eine 1:2-Randomisierung auf Placebo oder Enpatoran 100 mg 2x täglich (BID), im folgenden Teil 2 wurden die Patienten zusätzlich zur SoC 1:1:1:1 für 24 Wochen auf Placebo (n=94), Enpatoran 25 mg BID (n=71), 50 mg BID (n=74) oder 100 mg BID (n=114) randomisiert. Der primäre Endpunkt, eine Dosis-Wirkungs-Beziehung im BICLA-Ansprechen in Woche 24, wurde verfehlt, alle Dosen waren mit höheren BICLA-Ansprechen im Vergleich zu Placebo assoziiert (Abb.), mit einer nominal signifikanten Verbesserung in der 25 mg BID-Gruppe (57,7 vs. 39,4 %; p=0,0088). Größer (und durchweg signifikant) war die Differenz im sekundären Endpunkt BICLA-Ansprechen plus klinisch bedeutsame GK-Reduktion (25 mg BID: 58,8 vs. 31,4 %; p=0,0056).
Der größte Therapieeffekt zeigte sich in den Subgruppen mit hoher Interferon-Gensignatur (IFN-GS) oder einer GK-Dosis ≥10 mg zu Baseline (25 mg BID: 61,1 vs. 31,3 %; p=0,0013, bzw. 67,6 vs. 37,3 %; p=0,0071). Bei Patienten mit einem CLASI-A-Score ≥8 zu Baseline waren die BICLA-Ansprechraten für Enpatoran in Woche 24 jeweils signifikant höher als für Placebo (25 mg BID: 58,6 vs. 31,7 %; p=0,0152), bis zu 81,5 bzw. 60,5 % der Patienten auf Enpatoran erreichten ein CLASI-50/70-Ansprechen (vs. 41,5 bzw. 26,8 % unter Placebo). Die Rate an therapieassoziierten Nebenwirkungen (TEAE) war ähnlich wie unter Placebo (Bereich: 61–64 %), einschließlich der häufigsten TEAE (Infektionen und Infestationen). Auch hier war keine Dosisabhängigkeit erkennbar. In dieser Phase-II-Studie wurde Enpatoran gut vertragen und war in Subgruppen (hohe IFN-GS, hoher Steroidbedarf, viel Hautausschlag) effektiv, ob auf dieser Basis eine weitere Exploration in Phase-III erfolgt, bleibt abzuwarten. (1)
Dapirolizumab, Obinutuzumab und CAR-T-Zelltherapien
Bereits auf dem ACR-Kongress waren positive Daten der 48-wöchigen, randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie PHOENYCS-GO zu Dapirolizumab pegol (i.v. 24 mg/kg alle 4 Wochen) präsentiert worden. Jetzt nachgeschoben wurden von wiederum Eric Morand und internationalen Kollegen die Ergebnisse bei Anlegen der Therapieziele Remission (gemäß den DORIS-Kriterien) und niedriger Krankheitsaktivität (LLDAS). 208 bzw. 107 Patienten waren auf Dapirolizumab pegol oder Placebo plus SoC randomisiert worden (im Mittel 43,5 vs. 41,5 Jahre, SLEDAI 10,7 vs. 11,2, GK-Dosis 7,9 vs. 9,6 mg/Tag). In Woche 48 erreichten 40,9 % der Patienten mit Dapirolizumab pegol einen LLDAS im Vergleich zu 19,6 % unter Placebo (nominal p<0,0001). Ein höherer Anteil erreichte zudem eine DORIS-Remission in Woche 48 (19,2 % vs. 8,4 %; nominal p=0,0056). Die Ergebnisse bestätigen den potenziellen Stellenwert von Dapirolizumab pegol bei SLE, eine weitere Phase-III-Studie (deren Abschluss 2027 erwartet wird) läuft noch. (2)
Kurz vor der Zulassung bei LN steht nach den positiven Ergebnissen der Phase-III-Studie REGENCY Obinutuzumab. Eine weitere Analyse von Brad H. Rovin, Columbus (USA), und Kollegen zum vollständigen renalen Ansprechen (CRR) in Woche 76 nach verschiedenen Kriterien bestätigte dessen Nutzen mit einer konsistenten Effektgröße vs. Placebo von 13-16 %. (3)
Die nur den schwersten SLE-Fällen vorbehaltene CAR-T-Zelltherapie schreitet weiter voran. Positive Daten eines „off-the-shelf“ CD19-CAR-T-Zellprodukts aus den USA (Rese-cel) stellte Saira Sheikh, Chapel Hill, vor. In der RESET-SLE-Studie (zwei weitere Studien laufen zu Myositis und systemischer Sklerose) erreichten drei von vier non-renalen SLE-Patienten eine volle Remission und auch der erste mit LN. Alle bisher 7 Patienten mit einem Follow-up von 52 Wochen konnten ihre Medikation (Immunsuppressiva, GK) vollständig absetzen. (4) Positive Daten zu 10 therapierefraktären SLE-Patienten stellte eine chinesische Gruppe um Qiong Fu, Shanghai, vor, die dabei mit bislang gutem Erfolg auf eine duale CD19/BCMA-CAR-T-Zelltherapie setzten. (5) Aufgrund der einfacheren Herstellung könnte eine allogene gegenüber der bisher gängigen autologen CAR-T-Zelltherapie Vorteile haben. Diesen Weg verfolgten nun chinesische Experten um Ruina Kong, Shanghai, die bei 26 SLE-Patienten allogene CD19-CAR-NK-Zellen einsetzten. Schwere Nebenwirkungen (CRS, ICANS) blieben bis dato aus, von 12 Patienten mit einem Follow-up >12 Monate erreichten 66,7 bzw. 75 % eine DORIS-Remission respektive LLDAS. (6) Kaum hatten im vergangenen Jahr die BiTE-Antikörper für Furore gesorgt, stellte jetzt (wieder) ein chinesisches Team um Yingfeng Huang, Shanghai, ermutigende, aber noch sehr frühe Daten zum Einsatz von CC312, einem ersten tri-spezifischen CD19/CD3/CD28-Antikörper, u. a. bei schwerem SLE vor. (7)
Quellen:
1 Ann Rheum Dis 2025; 84 (Suppl 1): 316 (LB0004)
2 Ann Rheum Dis 2025; 84 (Suppl 1): 167 (OP0201)
3 Ann Rheum Dis 2025; 84 (Suppl 1): 6 (OP0006)
4 Ann Rheum Dis 2025; 84 (Suppl 1): 168 (OP0202)
5 Ann Rheum Dis 2025; 84 (Suppl 1): 65 (OP0047)
6 Ann Rheum Dis 2025; 84 (Suppl 1): 321 (LB0009)
7 Ann Rheum Dis 2025; 84 (Suppl 1): 319 (LB0007)