Einerseits gab es bei keiner anderen rheumatologischen Erkrankung so viele therapeutische Neuerungen wie bei der PsA, andererseits ist bis zum Jahr 2016 keine Angleichung des Sterberisikos im Vergleich zur Allgemeinbevölkerung erkennbar, erläuterte Behrens. Sogar noch größer ist die Diskrepanz bei der Psoriasis. Ein relevanter Treiber der Mortalität bei PsA und Pso sind CV-Ereignisse. Obwohl nicht akut praxisrelevant, gelang es in einer prospektiven Studie mit zielgerichtetem metabolomischem Profiling Risikofaktoren für ein erhöhtes CV-Risiko bei PsA- und Pso-Patienten zu identifizieren. Als unabhängige Prädiktoren erwiesen sich Acetoatat, Glykoproteine, Apolipoprotein B, Restcholesterin, Very Low-Density Lipoprotein (VLDL)-Cholesterin und kleinste VDL-Partikel, protektiv waren hingegen Alanin, Tyrosin, Laktat, HDL-Cholesterin und mittlere bis große HDL-Partikel.
Risikofaktoren, aktuelle und neue Wirkstoffe
Der Übergang von der Pso zur PsA ist fließend, prädiktive Faktoren hierfür auch jenseits z. B. der Nagelpsoriasis sind vielfach beschrieben worden. Frühe Anhaltspunkte für eine beginnende, oft noch (sub)klinische PsA kann in Zentren ein vaskuläres Imaging liefern. Ein kritischer Faktor für ein erhöhtes Risiko ist etwa die Detektion früher struktureller enthesialer Läsionen, die in einer deutschen Studie mittels HR-pQCT nachgewiesen wurden. Auch ein hoher aktueller (oder früherer) BMI können das Risiko für die Transition zur PsA steigern, bei manifester PsA verschlechtert sich zudem das Therapieansprechen. Überdies scheinen auch die bei Psoriasis eingesetzten Therapien das Risiko für die Entwicklung einer PsA beeinflussen. Zwar fehlt es (noch) an prospektiven Studien, inzwischen zeigen aber mehrere retrospektive Kohortenstudien recht übereinstimmend ein geringeres PsA-Risiko bei mit bDMARDs behandelten Pso-Patienten im Vergleich zu solchen, die nur topisch oder mit csDMARDs behandelt wurden. Eine Kausalität ist noch nicht bewiesen, aber ein früherer Einsatz von bDMARDs bei Patienten mit signifikanter Pso wäre sicherlich sinnvoll.
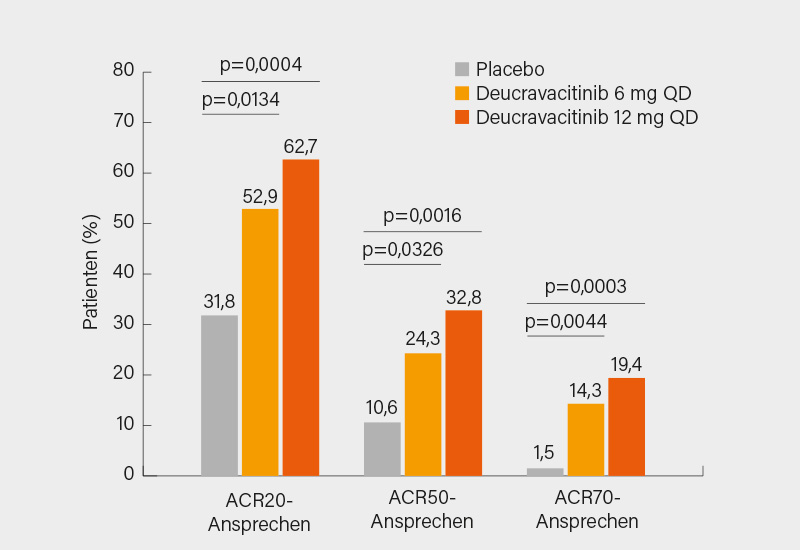
In Sachen Therapiemanagement sind die EULAR-Empfehlungen kürzlich auf den neuesten Stand gebracht worden. Die wichtigste Änderung ist wohl die nach csDMARD-Versagen ausgesprochene Gleichstellung von TNFα-, Interleukin (IL)-12/23- und IL-17A-Inhibitoren, so Behrens. Schon jetzt überholt scheint (neben der noch nicht erfolgten Berücksichtigung des inzwischen zugelassenen IL-23-Inhibitors Guselkumab) die Empfehlung, Januskinase (JAK)-Inhibitoren erst dann einzusetzen, wenn bDMARDs „unangemessen“ erscheinen. So wurden seitdem die Phase-III-Studien SELECT-PsA 1 (DMARD-IR) und SELECT-PsA 2 (bDMARD-IR) publiziert, die eine starke Wirksamkeit des präferenziellen JAK-1-Inhibitors Upadacitinib nachwiesen. In SELECT-PsA 1 zeigte sich die nicht zugelassene höhere Dosierung (30 mg) in einem adäquat gepowerten Vergleich Adalimumab überlegen, die zugelassene 15 mg-Dosierung ist diesem (Haut, Gelenke, minimale Krankheitsaktivität) ebenbürtig mit teils numerischen Vorteilen. Ob auch Filgotinib bei PsA weiterentwickelt wird, ist offen – aktuell liegt das Phase-III-Programm bei PsA (und röntgenologischer axSpA) noch auf Eis. Auch angesichts der gegenwärtigen Diskussionen zur Sicherheit der JAK-Inhibitoren könnte laut Behrens bei PsA der Tyrosinkinase (TYK)-2-Inhibitor Deucravicitinib ein Wechsel auf die Zukunft sein. In einer Phase-II-Studie zeigte sich bei einem guten Sicherheitsprofil in einem teils mit TNFα-Inhibitoren (ca. 30 %) vorbehandelten PsA-Kollektiv nach csDMARD-Versagen eine hohe Wirksamkeit beider Dosierungen (6 oder 12 mg/Tag) (Abb.). Auf künftige Phase-III-Daten kann man bereits gespannt sein.
Quelle: Plenarsitzung „Neue Behandlungskonzepte bei Arthritis“, DGRh-Kongress, 16. September 2021