Zunächst zur besagten Sequenztherapie: Die B-Zell-Depletion mit Rituximab ist bei SLE zwar fraglos effektiv, in zwei randomisierten, kontrollierten Studien war der primäre Endpunkt jedoch verfehlt worden. Da Rituximab den mit subsequenten Schüben assoziierten B-Zell-aktivierenden Faktor (BAFF)-Spiegel erhöht, könnte dies dessen Effektivität limitieren. Eine sich direkt an Rituximab anschließende Gabe des Anti-BAFF/BLyS-Antikörpers Belimumab könnte somit eine interessante Therapiestrategie bei Patienten mit SLE sein.
BEAT-LUPUS: Positive Phase-II-Daten zu Sequenztherapie
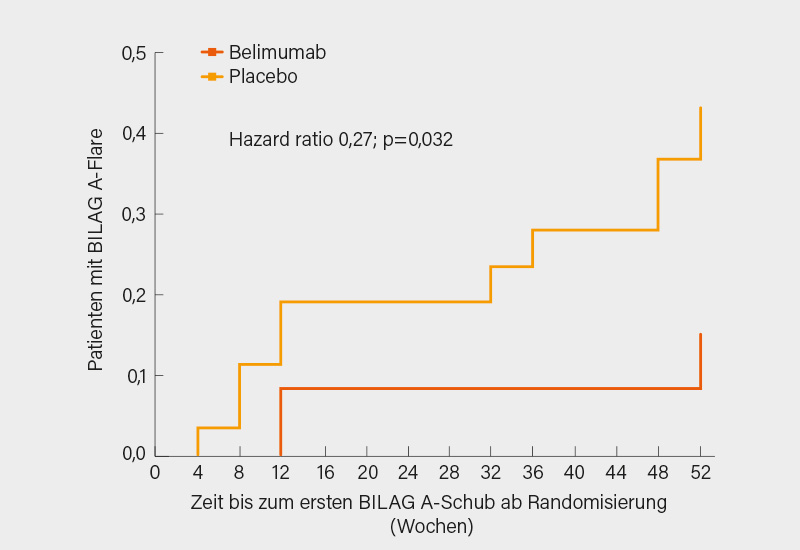
Die Sicherheit und Effektivität dieser Sequenz aus Rituximab und Belimumab i.v. wurde jetzt in der von Michael Ehrenstein, London (Großbritannien), erstmals vorgestellten 52-wöchigen, randomisierten, doppelblinden, placebokontrollierten Phase-IIb-Studie BEAT-LUPUS untersucht. Die maximal erlaubte Prednisolon-Dosis waren 20 mg/Tag, angestrebt wurde eine Reduktion um 50 % bis Monat 6. Primärer Endpunkt war der IgG Anti-dsDNA-Antikörper-Serumspiegel in Woche 52, adjustiert auf die Werte beim Screening (vor Rituximab) und zum Zeitpunkt der Randomisierung (4-8 Wochen nach 1. Rituximab-Infusion), CD19 > oder <0,01 x 109/l bei Randomisierung und Nierenbeteiligung beim Screening. Sekundäre Endpunkte waren die Krankheitsaktivität, unerwünschte Ereignisse (UE) und B-Zell (CD19)-Zahlen. 52 Patienten mit aktivem SLE erhielten 2 Rituximab-Infusionen in 2-wöchigem Abstand und wurden dann 4-8 Wochen nach der 1. Rituximab-Dosis im Verhältnis 1:1 auf Belimumab oder Placebo randomisiert. Bis Woche 52 blieben 32 Patienten in der Studie – die Drop-outs waren gleichmäßig verteilt.
Im Ergebnis zeigte sich in der Intention-to-treat (ITT)-Analyse mit 43 Patienten eine signifikante Reduktion des IgG Anti-ds-DNA-Antikörperspiegels unter Belimumab in Woche 52 (p<0,001 vs. Placebo). Überdies kam es zu einer signifikanten Reduktion schwerer Schübe (BILAG A) gegenüber Placebo (Hazard ratio, HR 0,27, 95% KI 0,07-0,97; p=0,03) (Abb.), schwere und moderate Schübe (BILAG A oder 2B) wurden numerisch reduziert (HR 0,53; p=0,14). Weder für die kumulative Steroiddosis noch Infektionen und alle und schwere UE waren Unterschiede zu verzeichnen. Belimumab unterdrückte signifikant die B-Zell-Rekonstitution in Woche 52 (p=0,001), nicht hingegen den Gesamt-Serum IgG-Spiegel.
Angesichts dieser positiven Ergebnisse mit einer signifikanten Reduktion schwerer Schübe bei gutem Sicherheitsprofil sollte dieses Therapieprinzip am besten in einer Phase-III-Studie evaluiert werden – auch um die Resultate gerade zur Schubreduktion in einer größeren Kohorte zu bestätigen. (1)
Kutaner LE: Ergebnisse einer Phase-II-Studie zu Iberdomid
Zu den potenziell interessanten Neuentwicklungen zählt der auch beim multiplen Myelom geprüfte, orale, hoch affine Cereblon-E3-Ligase-Modulator Iberdomid, der die Ubiquitinierung und proteasomale Degradation von Ikaros (IKZF1) und Aiolos (IKZF3), zwei mit dem genetischen SLE-Risiko verbundenen Transkriptionsfaktoren, fördert. Dieser neue Immunmodulator wurde in einer von Victoria Werth, Philadelphia (USA), vorgestellten internationalen, randomisierten, placebokontrollierten Phase-IIb-Studie untersucht, deren Ergebnisse in den Grundzügen bereits auf dem virtuellen ACR-Kongress 2020 präsentiert worden waren.
Im Vordergrund dieser Analyse stand die Wirksamkeit von Iberdomid auf den kutanen LE. In der Studie wurden 288 erwachsene Patienten mit Autoantikörper-positivem SLE mit einem SLEDAI 2K-Score ≥6 im Verhältnis 2:2:1:2 für 24 Wochen zusätzlich zu einer Standardtherapie (SoC) auf Iberdomid (0,45, 0,3, 0,15 mg/Tag) oder Placebo randomisiert. Der primäre Endpunkt eines SLE Responder Index (SRI)-4-Ansprechens in Woche 24 war mit der 0,45 mg-Dosierung in Woche 24 erreicht worden (54,3 vs. 34,9 %; p=0,011). Im Fokus stand jetzt aber das mit dem Cutaneous Lupus Area and Severity Index Activity-Score (CLASI-A; im Mittel 6,9 zu Baseline) sowie dem CLASI 50-Kriterium erfasste Ansprechen bei Patienten mit akutem (ACLE, 56 %), subakutem (SCLE, 29 %) und chronischem kutanen Lupus (CCLE, 16 %).
Aufgrund eines hohen Placebo-Ansprechens waren beim CLASI 50-Kriterium keine Vorteile von Iberdomid bei allen Patienten und auch solchen mit einem CLASI-A ≥8 erkennbar. Numerisch besser schnitt Iberdomid 0,45 mg in Woche 24 im ΔCLASI ab Baseline bei Patienten mit einem initialen CLASI-A ≥8 ab. Signifikante Vorteile bot die höchste Dosierung beim CLASI 50-Ansprechen für Patienten mit SCLE und CCLE (p<0,04). SCLE-Patienten profitierten zudem von einer signifikant stärkeren Verbesserung im CLASI A bis Woche 24 (p<0,03). Die Therapieunterschiede im CLASI-A zwischen Iberdomid 0,45 mg und Placebo waren noch größer in den SCLE- bzw. CCLE-Subgruppen mit hohem Baseline-Aiolos oder ausgeprägter Typ 1-IFN-Gensignatur (bei SCLE war dies signifikant).
Somit zeigte Iberdomid in der höchsten Dosierung eine vor allem in den SCLE/CCLE-Subgruppen (hohes Aiolos bzw. Typ-1 IFN) gute Wirksamkeit bei überwiegend guter Verträglichkeit. Eine Weiterentwicklung des neuen Therapieprinzips bei SLE scheint somit gerechtfertigt. (2)
Update zu den DORIS-Remissionskriterien
Bereits vor einer Reihe von Jahren bemühte sich eine internationale Task Force um die Erarbeitung von Remissionskriterien für den SLE. Die final konsentierte Fassung stellte auf dem EULAR stellvertretend Ronald van Vollenhoven, Amsterdam (Niederlande), vor.
Die DORIS-Remissionskriterien fordern nun einen klinischen (c)SLEDAI =0 und ein globales Arzturteil (PhGA) <0,5 unabhängig von der Serologie, auch Antimalariamittel, Low-Dose-Glukokortikoide ≤5 mg/Tag und/oder eine stabile immunsuppressive Therapie einschließlich Biologika sind gestattet. Damit entschied man sich, die Serologie (Anti-dsDNA, Komplement) außen vor zu lassen, da sie die Remission unter Therapie nicht wesentlich beeinflusste. Auch die Dauer der Remission wird nicht mehr berücksichtigt. Der SLEDAI-basierten Definition wurde Vorrang vor BILAG- oder ECLAM-basierten Definitionen eingeräumt. Da die medikamentenfreie Remission in der Praxis kaum erreichbar ist, wurde diese letztlich als Kriterium verworfen.
Für klinische Studien wird neben den DORIS-Remissionskriterien auch der LLDAS als Outcome-Parameter empfohlen. (3) Welches der beiden Kriterien am Ende primär genutzt wird – beide haben, wie auf einer eigenen Sitzung diskutiert, Vor- und Nachteile – wird sich in Zukunft zeigen.
Paradigmenwechsel bei Therapie der Lupusnephritis?
Abschließend sei eine Session zur LN erwähnt, auf der eine Lanze für den vermehrten Einsatz von Kombinations- anstelle von Sequenztherapien gebrochen wurde. Jenseits der derzeit oft noch zu geringen renalen Ansprechraten bieten mehrere aktuelle Studien Anlass zu einer solchen Diskussion.
Zu nennen wären hier die bislang größte Phase-III LN-Studie, BLISS-LN, die beispielsweise höhere Raten eines kompletten renalen Ansprechens (CRR) unter Belimumab plus Cyclophsphamid (CYC) oder Mycopenolat Mofetil (MMF) gegenüber deren alleiniger Anwendung nachwies. In der Phase-III-Studie AURORA war der CNI Voclosporin plus MMF ebenso MMF plus SoC im CRR signifikant überlegen. Gleiches gilt in der Phase-II-Studie NOBILITY für den selektiven Anti-CD20-Antikörper Obinutuzumab plus MMF gegenüber MMF plus SoC. Noch offen sind die Daten der TULIP-LN-Studie zu Anifrolumab, das gleichfalls in Kombination mit MMF gegenüber MMF (plus SoC) geprüft wird.
Nachdem in den genannten Studien die Kombinationstherapie mit einer jeweils akzeptablen Sicherheit verbunden war, könnte es sein, dass die traditionelle Unterteilung in eine sequenzielle Induktions- und Erhaltungstherapie im Praxisalltag künftig so nicht mehr sinnvoll ist.
Quellen:
1 Ann Rheum Dis 2021; 80(Suppl1): 74 (OP0129)
2 Ann Rheum Dis 2021; 80(Suppl1): 76-77 (OP0132)
3 Ann Rheum Dis 2021; 80(Suppl1): 181-182 (OP0296)