PMR: Update zur Diagnostik und Lehren aus der Leitlinie
Bei PMR belegen kürzlich publizierte deutsche Krankenversicherungsdaten eine deutlich höhere Prävalenz und Inzidenz (111 bzw. 937/100.000) als zuvor angenommen wurde. Die Diagnose wurde nur zu 11 % bei Rheumatologen gestellt, auch wurden nur 21 % nach der Diagnose einem Rheumatologen zugewiesen. Dies steht im Widerspruch zur sicher nicht unumstrittenen Forderung der deutschen S2e-Leitlinie, wonach jeder PMR-Betroffene schnellstmöglich zur Diagnosesicherung, Risikostratifizierung und Therapieentscheidung an Rheumatologen überwiesen werden sollte – die Weiterbehandlung mit einer Glukokortikoid (GK)-Monotherapie kann beim Hausarzt erfolgen. Obwohl in der Praxis schwierig, wurde diese Forderung von Dejaco angesichts der hohen diagnostischen Unsicherheit und GK-Langzeitrisiken ausdrücklich befürwortet, umso mehr bei diffizileren Fällen, wenn etwa eine Biologika-Verordnung gefragt ist. Hilfreich sei auch bei V. a. PMR eine Rapid-Access-Strategie, was vor Zuweisung u. a. die Rate GK-vorbehandelter Patienten senkte. Eine GK-Vortherapie erschwert, wie eine andere Studie zeigte, doch die Diagnosestellung, auch eine temporäre GK-Unterbrechung hilft dann nicht.
In Bezug auf die Therapie wird in der S2e-Leitlinie bei Patienten mit rezidivierender PMR neu die Kombination von GK mit einem Interleukin (IL)-6-Rezeptorinhibitor (nur Sarilumab ist zugelassen) empfohlen, auch initial kann dies bei hohem Risiko für GK-Nebenwirkungen erwogen werden. Gefordert wird in solchen Fällen aber ein rascheres Absetzen von GK nach 16 Wochen (bei GK-Monotherapie 12 Monate, bei Kombination mit Methotrexat [MTX] 6-8 Monate). Dass auch Tocilizumab bei PMR in puncto Remission und GK-Einsparung gut funktioniert, hatte eine französiche Phase-III-Studie belegt, ein Follow-up zeigte nun, dass 24 Wochen nach dessen Absetzen nur noch 27 % der Teilnehmer in Rezidiv-freier Remission waren - dies ist in ähnlicher Weise wohl auch für Sarilumab zu vermuten, so Dejaco. In Phase-II wurde der JAK-Inhibitor Baricitinib in der BACHELOR-Studie mit gutem Erfolg (bis Woche 24 79 % in Remission, nur 6 % GK-Rescue-Therapie und 6 % mit Rezidiv) bei de-novo PMR geprüft, und zwar ohne orale GK (max. 2 GK-Injektionen in Woche 1 und 4 waren erlaubt). Eine weitere Exploration in Phase-III wäre sicherlich wünschenswert.
RZA: Upadacitinib neu zugelassen, aber auch Enttäuschungen
Bei der RZA ist ein Ultraschall (US) der Arteria temporalis und axillaris des bildgebende Verfahren der ersten Wahl. Schwierig bleibt im Verlaufsmonitoring die Prädiktion von Rezidiven. Im Hinblick auf den US war in einer prospektiven Studie der OGUS-Score zu Baseline prädiktiv für das Rezidivrisiko (Hazard Ratio 2,8/Einheit), 67 % der Betroffenen hatten einen positiven US während des Rezidivs. Bei kranialer RZA können Rezidive auch bei nicht erhöhten Akute-Phase-Reaktanten mittels kranialer MRT nachgewiesen werden. Ein Prädiktor für Rezidive ist ferner ein Mosaikverlust des Y-Chromosoms (mLOY) – der häufigsten somatischen Mutation bei älteren Männern. Ab einem mLOY-Schwellenwert von 10,2 bestand ein signifikant höheres Risiko für RZA-Rezidive (Hazard Ratio 17,4!).
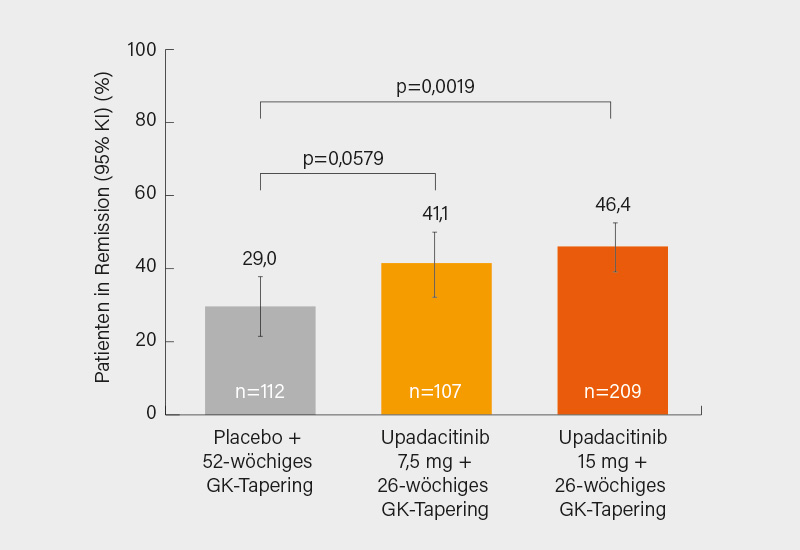
Nun zur Therapie: Bei therapierefraktären sowie rezidivierenden Verläufen oder bei einem erhöhten Risiko für GK-Nebenwirkungen werden zusätzlich zu GK Tocilizumab (oder als Alternative MTX) empfohlen. Weder GK noch Tocilizumab scheinen die Entzündung ganz zum Verschwinden zu bringen, was das hohe Rezidivrisiko (gut 50 %) auch nach Absetzen von Tocilizumab erklären dürfte. Eine neue zugelassene Option ist seit Kurzem der JAK-1-Inhibitor Upadacitinib (15 mg/Tag), der in der Phase-III SELECT-GCA-Studie signifikant den primären Endpunkt einer anhaltenden Remission in Woche 52 erreicht hatte (46,4 vs. 29,0 % unter Placebo) (Abb.), die kumulative GK-Dosis konnte ebenfalls verringert werden (1,6 vs. 2,9 g). Wie Upadacitinib relativ zu Tocilizumab einzuschätzen ist, bleibt ebenso offen wie die Frage, mit wie vielen Rezidiven nach dem Absetzen des JAK-Inhibitors zu rechnen ist. Große Hoffnung auf eine recht gut verträgliche und effektive Therapie mit dem IL-17A-Inhibitor Secukinumab hatte die deutsche Phase-II-Studie TitAIN geweckt (anhaltende Remission in Woche 52: 59 vs. 8 % unter Placebo, kumulative GK-Dosis 2,8 vs. 3,4 g). Wie jetzt vorab (im Juli) mitgeteilt wurde, erreichte Secukinumab (150 bzw. 300 mg) in der daraufhin lancierten Phase-III-Studie GCAptain bei Patienten mit neu diagnostizierter oder rezidivierender RZA jedoch nicht den primären Endpunkt einer anhaltenden Remission in Woche 52 – genauere Daten bleiben abzuwarten, ebenso wie der Ausgang der Phase-III-Studie REPLENISH bei PMR. Geringer waren sicher die Erwartungen in einer kleinen, COVID-19-bedingt vorzeitig abgebrochenen Phase-III-Studie zu dem IL-1-Inhibitor Anakinra – hier waren keinerlei Vorteile der Prüfsubstanz erkennbar.
Quelle: WIN-Session „PMR/RZA, SLE und Sjögren-Syndrom“, 18. September 2025