Die Pathogenese der SjE ist durch eine B-Zell-Überaktivität sowie gestörte BAFF/BAFF-R-Signalübertragung gekennzeichnet. Ianalumab ist ein vollständig humaner monoklonaler IgG1-Antikörper, der B-Zellen durch verstärkte antikörperabhängige zelluläre Zytotoxizität (ADCC) depletiert und zugleich deren Aktivierung und Überleben über die BAFF-R-Inhibition hemmt. Mit NEPTUNUS-1 und -2 wurden von Thomas Grader-Beck, Baltimore (USA), und internationalen Kollegen zwei komplementäre, 52-wöchige, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studien zu Ianalumab bei erwachsenen Patienten mit aktiver SjE präsentiert. Diese mussten die ACR/EULAR-Kriterien 2016 erfüllen und einen EULAR Sjögren’s Syndrome Disease Activity Index (ESSDAI)-Score ≥5 sowie stimulierten Speichelfluss ≥0,05 ml/min aufweisen. Eine immunsuppressive Komedikation mit Methotrexat (≤25 mg/Woche), Hydroxychloroquin (≤400 mg/Tag), Azathioprin (≤150 mg/Tag) und Prednison ≤10 mg/Tag war allein oder in Kombination in beiden Studien erlaubt.
Ianalumab: Konsistente Wirksamkeit in NEPTUNUS-1 und -2
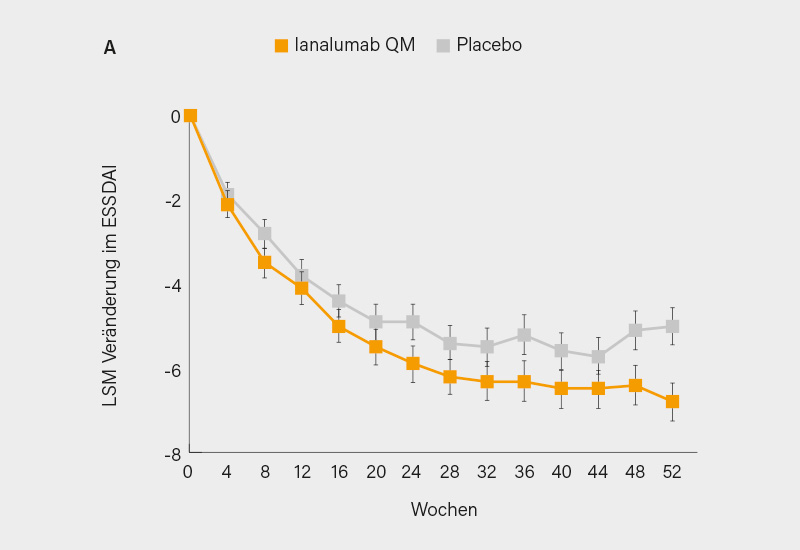
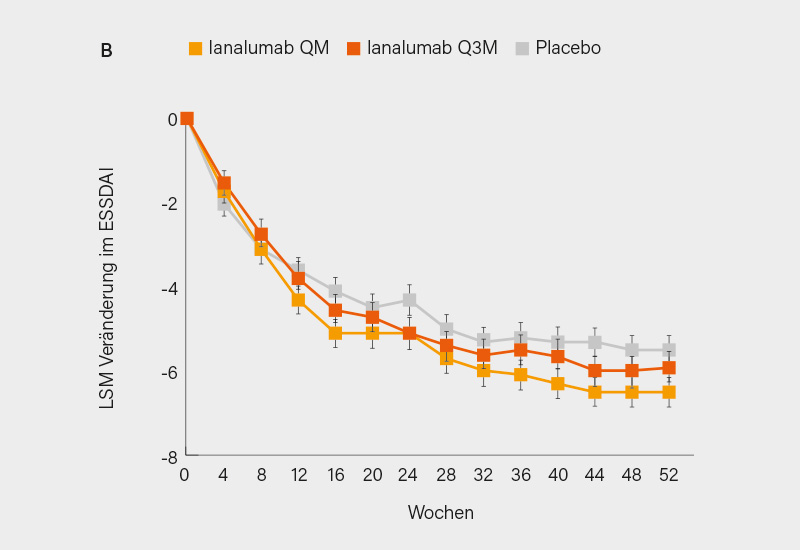
In NEPTUNUS-1 wurden 275 Patienten im Verhältnis 1:1 auf monatlich (QM) s.c. Ianalumab 300 mg oder Placebo randomisiert. In NEPTUNUS-2 erfolgte die Randomisierung von hier 504 Patienten in einem 1:1:1-Design auf Ianalumab 300 mg QM, alle 3 Monate (Q3M) oder Placebo. In beiden Studien war der primäre Endpunkt der Nachweis der Überlegenheit von Ianalumab versus Placebo hinsichtlich der Änderung des ESSDAI-Werts nach 48 Wochen. Beide Studien erreichten ihr primäres Ziel. Ianalumab QM zeigte nach 48 Wochen eine statistisch signifikante Verbesserung des ESSDAI im Vergleich zu Placebo (Abb. 1), wobei in NEPTUNUS-1 der Rückgang -6,4 vs. -5,1 Punkte (LSM Differenz [∆] -1,3, 95% KI -2,6 bis 0,0; p=0,0496) und in NEPTUNUS-2 -6,5 vs. -5,5 Punkte (LSM ∆ -1,0, 95% KI -2,0 bis 0,0; p=0,041) betrug (für Ianalumab 300 mg Q3M zeigte sich nur ein numerischer Vorteil). Im globalen Patienten- (PaGA; LSM ∆ -6,6; 95% KI -11,4 bis -1,8; p=0,007) und Arzturteil (PhGA; LSM ∆: -5,5; 95% KI -10,1 bis -0,9; p=0,018) fand sich in NEPTUNUS-1 eine nominale statistische Signifikanz. Weitere sekundäre Endpunkte zeigten in beiden Studien einen Trend zur Verbesserung. Ianalumab wies über 52 Wochen hinweg ein günstiges Sicherheitsprofil auf, wobei die Gesamtinzidenz von allen und schweren Nebenwirkungen (einschließlich Infektionen) mit der von Placebo in beiden Studien vergleichbar war.
Bei NEPTUNUS-1 und NEPTUNUS-2 handelt es sich um die ersten replizierten Phase-III-Studien bei SjE, die ihren primären Endpunkt erreichten, wobei Ianalumab 300 mg QM eine jeweils (knapp) signifikante Verbesserung der Krankheitsaktivität im ESSDAI zeigte. Darüber hinaus weisen sekundäre Endpunkte (PaGA, PhGA, z. T. stimulierter Speichelfluss) auf eine klinisch relevante Reduktion der Symptomatik hin (kaum Effekte auf ESSPRI und Fatigue). Der geringe Abstand zur hohen Placeborate (im ESSDAI gepoolt 1,2 Punkte; p=0,003) könnte der Komedikation geschuldet sein, die Ergebnisse aus den Subgruppen bleiben abzuwarten. Für Ianalumab spricht ein günstiges Sicherheitsprofil, was auf ein positives Nutzen-Risiko-Profil schließen lässt. (1) Globale Zulassungsanträge sind angekündigt, auch angesichts des Fehlens zugelassener Therapien dürften die Chancen ganz gut stehen.
Telitacicept: Gute Wirksamkeit in chinesischer Studie
Die Ergebnisse einer randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie zu Telitacicept bei der SjE stellten Xiaofeng Zeng, Peking (China), und Kollegen als Late breaking-Poster vor. Die auf positiven Phase-II-Daten aufsetzende Studie wurde an 79 Zentren in China durchgeführt. Eingeschlossen wurden 381 Patienten (18 bis 70 Jahre), die die ACR/EULAR-Kriterien von 2016 erfüllten, Anti-SSA-Antikörper-positiv waren und einen ESSDAI-Score ≥5 aufwiesen. Diese wurden über 48 Wochen im Verhältnis 1:1:1 (je n=127) auf s.c. Telitacicept 160 mg, Telitacicept 80 mg oder Placebo randomisiert. Von Woche 24 bis 48 konnten Patienten der Placebo-Gruppe mit unzureichendem Ansprechen verblindet 1:1 auf Telitacicept 160 mg oder 80 mg umgestellt werden. Primärer Endpunkt war die Veränderung des ESSDAI-Werts gegenüber dem Ausgangswert in Woche 24.
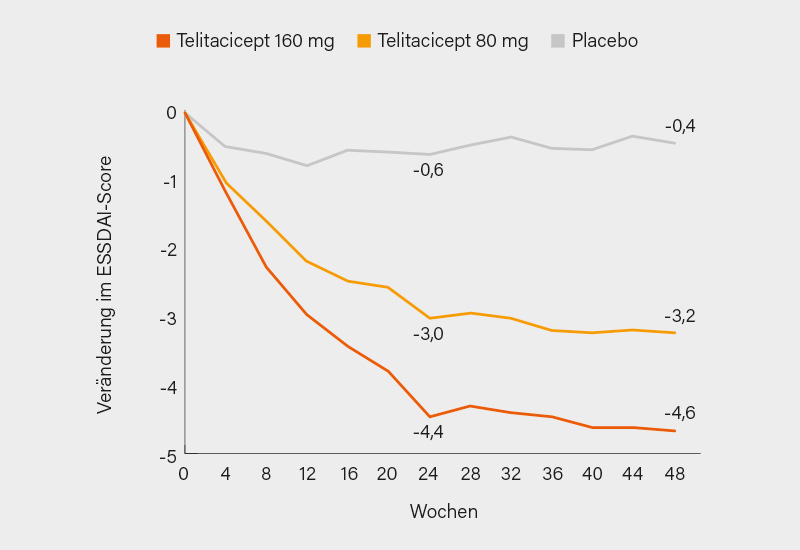
Im Vergleich zu Placebo zeigte sich in Woche 24 eine signifikante Abnahme des ESSDAI-Werts gegenüber Baseline unter Telitacicept 160 mg (LSM -4,4 vs. -0,6; p<0,0001) und Telitacicept 80 mg (LSM -3,0 vs. -0,6, p<0,0001). Die Wirksamkeit beider Telitacicept-Dosierungen hielt bis Woche 48 an, wobei Telitacicept 160 mg in Woche 48 eine stärkere Reduktion als 80 mg zeigte (LSM -4,6 vs. -3,2) (Abb. 2). Weitere Wirksamkeitsendpunkte in Woche 48 wie der Anteil der Patienten mit ≥3-Punkte-Reduktion im ESSDAI (73,0 vs. 16,5 % unter Placebo), Anteil der Patienten mit ESSDAI <5 (55,0 vs. 12,2 %), Anteil der Patienten mit ≥1-Punkte- oder ≥15 %-Reduktion im EULAR Sjögren’s Syndrome Patient Reported Index (ESSPRI) (89,1 vs. 33,3 %) und die Änderung des ESSPRI-Werts ab Baseline (-2,56 vs. -0,41) und im Anteil der Sjögren‘s Tool for Assessing Response (STAR)-Responder (82,7 vs. 26,0 %) zeigten eine konsistente Verbesserung unter Telitacicept 160 mg (und schwächer unter 80 mg).
Die meisten therapieassoziierten Nebenwirkungen waren leicht oder moderat, am häufigsten waren Infekte der oberen Atemwege (ca. 65 %; unter Placebo 58 %). Schwere unerwünschte Ereignisse waren ungefähr auf Placeboniveau (2,4 und 4,0 vs. 2,4 %). Somit wurde der primäre Endpunkt in dieser rein chinesischen SjE-Population erreicht. Gegenüber Placebo zeigten sowohl Telitacicept 160 mg als auch 80 mg über 48 Wochen hinweg eine konsistente Verbesserung der klinischen Symptome sowie ein günstiges Sicherheitsprofil, wobei mit der 160 mg-Dosis jeweils größere Verbesserungen beobachtet wurden. (2)
Auf den ersten Blick scheinen die Daten fast vielversprechender als jene zu Ianalumab zu sein (hier z. B. auch klarer Vorteil im ESSPRI), jedoch irritiert das für SjE-Studien sehr niedrige Placebo-Ansprechen. Auch angesichts des rein chinesischen Kollektivs bleiben hier doch einige Fragezeichen. Wie auch beim SLE (dort bereits angelaufen) ist für die SjE jetzt eine globale Phase-III-Studie geplant, bis zu einer potenziellen Zulassung in Europa wird also noch viel Zeit verstreichen.
Quellen:
1 Arthritis Rheumatol 2025; 77(Suppl. 9): Abstr. LB24
2 Arthritis Rheumatol 2025; 77(Suppl. 9): Abstr. LB11