Psoriasis-Arthritis
Deucravacitinib überzeugt in Phase-III-Studie bis Woche 16
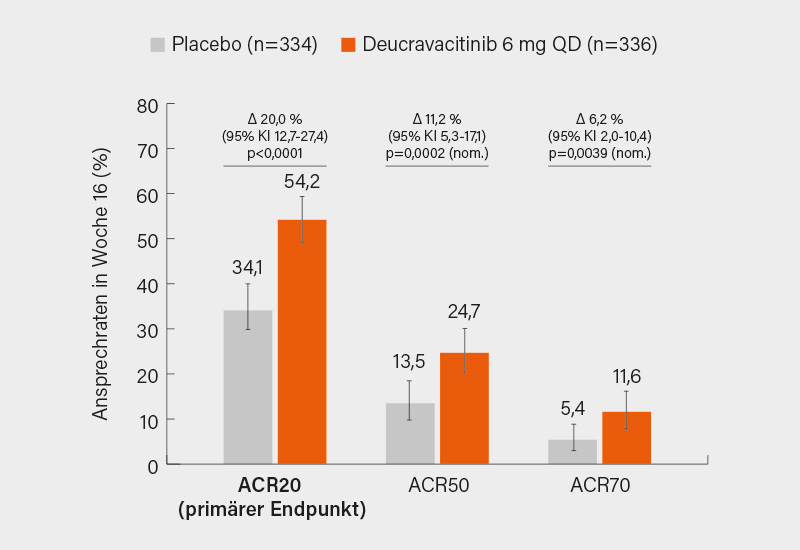
In der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie POETYK PsA-1 wurde der selektive orale TYK-2-Inhibitor Deucravacitinib bei erwachsenen Patienten mit aktiver PsA eingesetzt, die bisher keine Biologika erhalten hatten. Die 670 eingeschlossenen Patienten litten unter aktiver Arthritis (≥3 geschwollene und ≥3 druckschmerzhafte Gelenke), aktiver oder dokumentierter Psoriasis sowie mindestens einer erosiven Läsion in Hand- oder Fußgelenken (und somit erhöhtem Risiko für eine radiografische Progression).
Nach 16 Wochen erreichten signifikant mehr Patienten unter Deucravacitinib im Vergleich zu Placebo eine ACR20-Response (54,2 vs. 34,1 %; p<0,0001) (Abb. 1). Auch das ACR50- und ACR70-Ansprechen sowie sekundäre Endpunkte wie HAQ-DI, PASI 75, SF-36 PCS und minimale Krankheitsaktivität (MDA) wurden signifikant verbessert. In post-hoc-analysierten MRT-Daten zeigte sich zudem eine signifikante Hemmung des radiografischen Progresses im Vergleich zu Placebo, obwohl der primäre (parametrische) Radiografie-Endpunkt verfehlt wurde. Die Substanz erwies sich insgesamt als gut verträglich. Am häufigsten trat ein Infekt der oberen Atemwege auf (5,1 vs. 3,0 % unter Placebo). Schwere Nebenwirkungen und Therapieabbrüche waren selten. Es traten keine Sicherheitssignale bezüglich schwerer kardiovaskulärer (MACE) bzw. thromboembolischer Ereignisse, Malignome oder opportunistischer Infektionen auf. Diese Ergebnisse bestätigen die Wirksamkeit von Deucravacitinib bei aktiver PsA über multiple Domänen (auch wenn die Frage der Hemmung der radiografischen Progression nicht eindeutig beantwortet wurde) hinweg und unterstreichen dessen günstiges Sicherheitsprofil – konsistent mit vorangegangenen Studien in Psoriasis und PsA. (1)
Gestützt wird diese Einschätzung durch die 52-Wochen-Daten der POETYK PsA-2-Studie mit 729 PsA-Patienten (die Einschlusskriterien waren fast identisch, es war aber keine Gelenk-
erosion gefordert). Bei guter Verträglichkeit wurden mit kontinuierlicher Deucravacitinib-Therapie oder nach einem Wechsel darauf ab Woche 16 ACR20/50/70-Ansprechraten von bis zu 67, 43 bzw. 27 % sowie eine MDA von bis zu 41 % der Studienteilnehmer erreicht. Schwerwiegende Nebenwirkungen wurden auch in dieser Studie nicht verzeichnet. (2) Angesichts der bereits vorliegenden Zulassung bei Plaque-Psoriasis ist wohl von einer künftigen Indikationserweiterung von Deucravacitinib auszugehen.
Guselkumab hemmt radiografische Progression in APEX-Studie
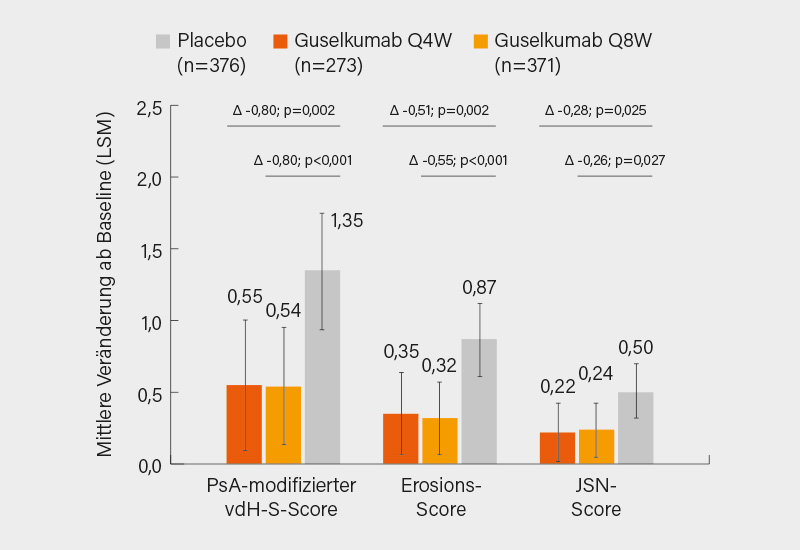
Die Phase-IIIb-Studie APEX untersuchte Guselkumab, einen selektiven Interleukin (IL)-23(p19)-Inhibitor, bei Biologika-naiven Patienten mit aktiver PsA und nachgewiesenen Erosionen in peripheren Gelenke und damit hohem Risiko für eine radiografische Progression. Im Fokus standen sowohl klinische als auch bildgebende Endpunkte. Insgesamt wurden 1.020 Patienten in drei Gruppen randomisiert: Guselkumab 100 mg alle 4 Wochen (Q4W), Guselkumab 100 mg mit Verlängerung auf alle 8 Wochen (Q8W) nach Woche 4, oder Placebo.
Nach 24 Wochen erreichten 67 % (Q4W) und 68 % (Q8W) der mit Guselkumab behandelten Patienten ein ACR20-Ansprechen, verglichen mit 47 % unter Placebo (p<0,001). Auch im Hinblick auf die strukturelle Progression zeigte sich ein signifikanter Vorteil: Die mittleren Veränderungen im PsA-modifizierten van der Heijde-Sharp (vdH-S)-Score betrugen 0,55 (Q4W) bzw. 0,54 (Q8W) versus 1,35 unter Placebo (p=0,002 bzw. <0,001) (Abb. 2). Zudem wurde ein höherer Anteil an Patienten ohne radiologisches Fortschreiten beobachtet. Ähnliche Muster zeigten sich bei Erosions- und Gelenkspaltverschmälerungs (JSN)-Scores. Unerwünschte Ereignisse waren vergleichbar zwischen den Gruppen (37-42 %), mit meist milder bis moderater Ausprägung. Es traten keine neuen Sicherheitssignale auf. (3)
Obwohl heutzutage nur ein kleiner Teil der PsA-Patienten eine klinisch relevante radiografische Progression zeigt, liefern die Ergebnisse der APEX-Studie dennoch einen wichtigen Hinweis: Eine konsequente Kontrolle der Entzündung – wie sie unter Guselkumab erreicht wurde – geht mit einer signifikanten Hemmung des strukturellen Fortschreitens einher. Dies bestätigt die pathogenetische Relevanz der IL-23-Achse und unterstützt die Rolle von Guselkumab als krankheitsmodifizierende Therapie bei PsA.
SPEED-Studie: Frühe intensive Therapie kann bei ungünstiger Prognose sinnvoll sein
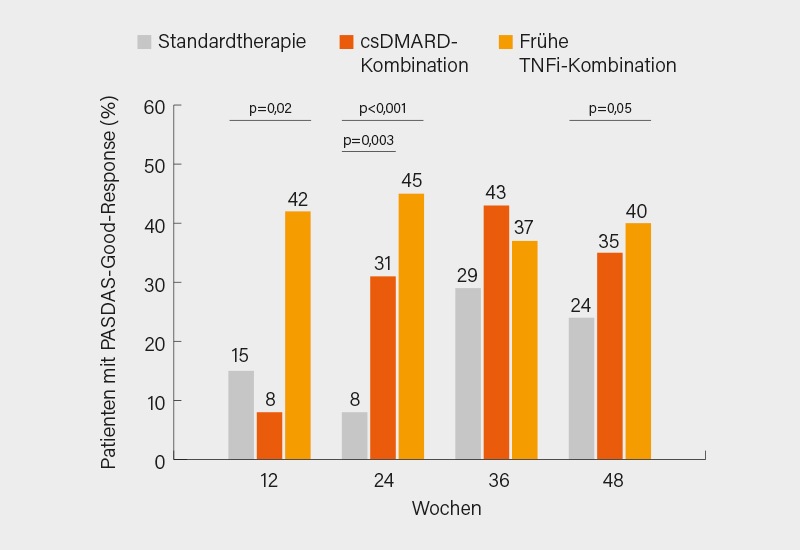
Die randomisierte SPEED-Studie verglich bei Patienten mit neu diagnostizierter PsA und ungünstigen Prognosefaktoren (z. B. Polyarthritis, hohe CRP-Werte, funktionelle Einschränkung oder Erosionen) drei Strategien: eine Standardbehandlung mit „Step-up“-csDMARDs, Kombinationstherapie mit csDMARDs (Methotrexat plus Sulfasalazin oder Leflunomid) und die frühzeitige Einleitung einer TNF-Inhibition (Methotrexat plus Adalimumab für 24 Wochen). Primärer Endpunkt war die Veränderung des PASDAS nach 24 Wochen.
Es zeigte sich eine signifikant bessere Krankheitskontrolle in beiden „intensiven“ Therapiearmen: Der PASDAS sank unter Therapie mit dem TNF-Inhibitor um durchschnittlich -1,09 (vs. Standard; p<0,001) und unter der csDMARD-Kombinationstherapie um –0,69 (p=0,02). Zwischen den beiden Interventionsarmen bestand kein signifikanter Unterschied. Während nach 24 Wochen beide intensiven Strategien überlegen waren, blieb der Effekt bis Woche 48 ausschließlich in der TNF-Inhibitor-Gruppe bestehen. Auch sekundäre Endpunkte wie PASDAS-Good-Response (Abb. 3)und Verbesserungen in DAPSA und PASI zeigten konsistente Vorteile der frühen intensiven Therapie. Nebenwirkungen waren insgesamt gering. Nicht schwerwiegende Nebenwirkungen traten häufiger unter der Kombinationstherapie auf (u. a. Leberfunktionsstörungen), während Infektionen unter dem TNF-Inhibitor häufiger waren (9,2 %). (4)
Diese Studie liefert Evidenz dafür, dass eine frühzeitige, intensive Therapie bei prognostisch ungünstiger PsA zu einer schnelleren und anhaltenderen Krankheitskontrolle führt. Auch wenn die Ergebnisse in dieser Studie mit einem TNF-Inhibitor erzielt wurden, ist es plausibel, dass sie sich auf andere wirksame bDMARDs und tsDMARDs mit vergleichbarem entzündungshemmendem Potenzial übertragen lassen.
Axiale Spondyloarthritis
Digitale Therapie verbessert Krankheitsaktivität und Lebensqualität
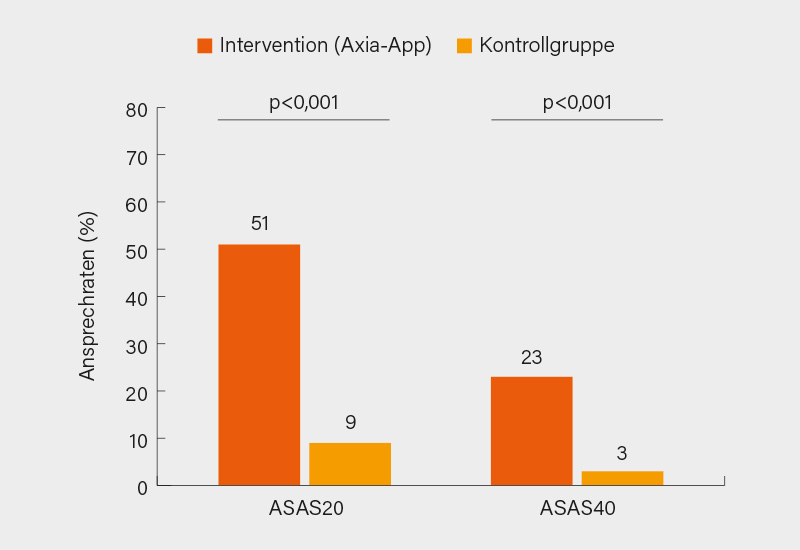
Digitale Gesundheitsanwendungen (DiGAs) haben in der Rheumatologie bislang kaum überzeugende Wirksamkeitsnachweise erbracht. In der randomisierten Bechterew-App-Studie wurde nun erstmals die neu entwickelte digitale Therapie Axia bei axSpA untersucht. Die App kombiniert individualisierte Heimübungsprogramme, strukturierte Patientenaufklärung und digitales Krankheitsmanagement mit gamifizierten Elementen zur Adhärenzförderung.
In die 12-wöchige Studie wurden 200 axSpA-Patienten mit einer stabilen Pharmakotherapie eingeschlossen und im Verhältnis 1:1 randomisiert. Primäre Endpunkte waren Veränderungen der Krankheitsaktivität (BASDAI), Funktion (BASFI) und krankheitsbezogenen Lebensqualität (ASQoL). Sekundäre Endpunkte umfassten das ASAS20- und ASAS40-Ansprechen. Die Teilnehmer in der Axia-Gruppe erzielten signifikante und klinisch relevante Verbesserungen: der mittlere BASDAI sank um -1,66 (vs. -0,11 in der Kontrollgruppe; p<0,001), der BASFI um -1,12 (vs. +0,06; p<0,001) und der ASQoL um -2,51 (vs. -0,16; p<0,001). Eine ASAS20-Ansprechen erreichten 51 % (vs. 9 %) der Teilnehmer und eine ASAS40-Response 23 % (vs. 3 %) (jeweils p<0,001) (Abb. 4). Es wurden keine Sicherheitsbedenken berichtet. (5)
Die Ergebnisse zeigen erstmals eine überzeugende Wirksamkeit einer digitalen Therapie in der axSpA. Trotz der nachgewiesenen Verbesserungen erscheint die Anwendung jedoch eher nicht als alleinige Behandlungsmethode geeignet, sondern vielmehr als potenzielle ergänzende Maßnahme im Rahmen eines multimodalen Therapiekonzepts.
Frühe Diagnose ermöglicht bessere Langzeitergebnisse
Die deutsche GESPIC-Kohorte ermöglichte eine prospektive Langzeitbeobachtung von axSpA-Patienten über bis zu 10 Jahre. Eine aktuelle Analyse untersuchte, ob das Erfüllen der kürzlich entwickelten ASAS-Kriterien für „frühe axSpA“ – definiert vor allem durch eine Symptomdauer ≤2 Jahre – zum Zeitpunkt der Diagnose bzw. des Behandlungsbeginns mit besseren langfristigen Krankheitsverläufen assoziiert ist. Von 525 Patienten erfüllten 161 (30,1 %) die Kriterien für frühe axSpA beim Studieneinschluss. Diese wiesen bei Beginn der Beobachtung eine nur geringfügig niedrigere Krankheitsaktivität auf (ASDAS 2,4 vs. 2,7).
Im Verlauf zeigten sich jedoch deutlich bessere Outcomes: Nach 10 Jahren erreichten 57 % der Patienten mit früher axSpA eine ASDAS-Remission oder niedrige Krankheitsaktivität, im Vergleich zu 43 % in der Gruppe mit später Diagnose. In multivariaten Modellen – adjustiert unter anderem auf Alter, Geschlecht, Ausgangsaktivität – war die frühe axSpA weiterhin signifikant mit dem Erreichen einer Remission assoziiert (ASDAS-ID: Odds Ratio 1,85; 95% KI 1,31-2,61).
Diese Daten belegen, dass die frühe Diagnose einer axialen SpA zum Zeitpunkt der Erstvorstellung mit besseren Langzeitergebnissen verbunden ist. Sie unterstreichen die hohe Relevanz einer frühzeitigen Erkennung und rechtfertigen gezielte diagnostische Strategien in der klinischen Praxis. Prospektive, interventionelle Studien zur frühen axSpA sind bereits initiiert – Ergebnisse werden in den kommenden Jahren erwartet.
Prof. Dr. med. Denis Poddubnyy
Division of Rheumatology, Department of Medicine,
University Health Network and University of Toronto,
Toronto, Kanada
Quellen:
1 van der Heijde D et al., Ann Rheum Dis 2025; 84 (Suppl 1): 313 (LB0001)
2 Mease PJ et al., Ann Rheum Dis 2025; 84 (Suppl 1): 84 (OP0095)
3 Mease PJ et al., Ann Rheum Dis 2025; 84 (Suppl 1): 321 (LB0010)
4 Massa S et al., Ann Rheum Dis 2025; 84 (Suppl 1): 77 (OP0089)
5 Strunz P et al., Ann Rheum Dis 2025, 84 (Suppl 1): 314 (LB0002)
6 Kiefer D et al., Ann Rheum Dis 2025, 84 (Suppl 1): 90 (OP0100)