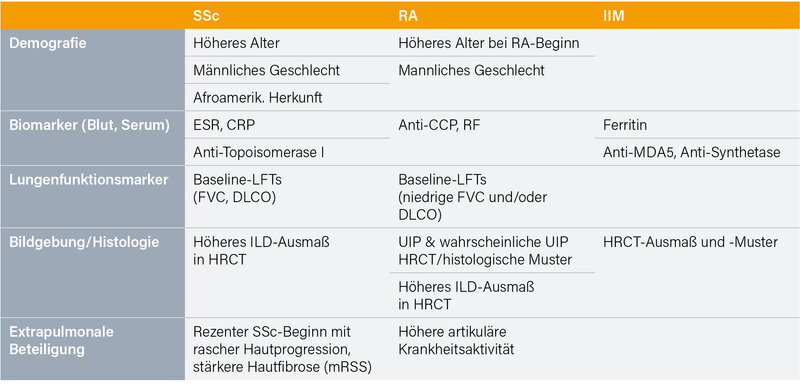
Die Leitlinienentwicklung stellte eine enorme Herausforderung dar, dargestellt sei hier nur eine Auswahl der wichtigsten (meist nur bedingten) Empfehlungen. So wird in Bezug auf das Screening bei allen Patienten davon abgeraten, das HRCT durch Lungenfunktionstests (LFTs) oder einen Lungenultraschall zu ersetzen (in jedem Fall sollten respiratorische Beschwerden sowie LFTs – FVC und DLCO – bei Symptomen oder abnormem CT untersucht/erfasst werden). Alle SSc- und MCTD-Patienten sowie IIM-Patienten (außer mit Einschlusskörpermyositis) mit Risikofaktoren sollten (mittels HRCT) gescreent werden, für alle Patienten mit RA und SjD mit Risikofaktoren und IIM-Patienten ohne Risikofaktoren wird es vorgeschlagen („könnte“). Als Risikofaktoren bei IIM gelten ein Antisynthetase-Syndrom (ASyS), klinisch amyopathische Dermatomyositis, „mechanics hands“, Arthritis, Anti-Synthestase/-MDA-5 und -Ro52-Antikörper, bei RA höheres Alter, Rauchen, erhöhter RF-Spiegel, ACPA-Positivität, erhöhte Entzündungsmarker, männliches Geschlecht und hohe Krankheitsaktivität (Abb.), bei SjD höheres Alter, eine aktive extra-pulmonale Organbeteiligung und erhöhte Entzündungsmarker. Für Empfehlungen zur Häufigkeit eines Screenings fehlt es an Evidenz; ggf. kann man sich hier an den Ratschlägen zum Monitoring orientieren.
Diagnostik und Monitoring
Be allen Patienten mit Diagnose einer ILD sollten die Prognose und das Progressionsrisiko (klinische Risikofaktoren, FVC/DLCO, HRCT-Muster und -Ausmaß, 6-Minuten-Gehtest (6MWD) und O2-Sättigung, PROs) bestimmt werden, zur Diagnosesicherung wird keine Lungenbiopsie empfohlen (diese kann aber bei atypischen Merkmalen im HRCT und/oder um Malignitäten auszuschließen durchgeführt werden) und eine bronochalveoläre Lavage (BAL) nur zum Ausschluss von Infektionen oder bestimmten Malignitäten (z. B. MALT-Lymphome) oder alveolärer Blutungen.
Ein Monitoring wird bei SSc-ILD in Abhängigkeit von Risiko (hoch vs. niedrig) und Krankheitsdauer (< vs. >3-5 Jahre) empfohlen mit einer LFT alle 3-6 bzw. 6-12 oder 6-12 bzw. 12 Monate, eine HRCT alle 12 Monate bzw. 2 Jahre (oder bei klinischer Indikation) und die 6MWD/O2-Sättigung sowie PROs alle 6-12 bzw. 12 Monate (dies gilt durchweg für alle Indikationen). Bei RA-ILD wird ebenso nach Risiko unterteilt (aber mit einer Krankheitsdauer <1-2 vs. >2 Jahre) und LFTs alle 6-12 Monate bzw. 12 Monate sowie eine HRCT alle 12 Monate bzw. 2 Jahre (oder bei klinischer Indikation) empfohlen, bei IIM-ILD (Krankheitsdauer <2 vs. >2 Jahre) eine LFT alle 3-6 bzw. 6-12 Monate (hohes Risiko) oder 6-12 bzw. 12 Monate (niedriges Risiko), eine HRCT nach 3-6 Monaten, dann jährlich bzw. jedes Jahr (hohes Risiko) oder jährlich (niedriges Risiko), bei anderen CTD-ILDs (Krankheitsdauer <1 vs. >1 Jahr) eine LFT alle 3-6 bzw. 6-12 Monate (hohes Risiko) oder alle 6-12 bzw. 12 Monate (niedriges Risiko), eine HRCT zu Jahr 1/alle 12 Monate bzw. zu Jahr 1 oder wenn klinisch indiziert.
Therapieempfehlungen kurz und kompakt
Zur Therapie werden bei SSc-ILD bei extra-pulmonaler Beteiligung Mycophenolat Mofetil (MMF) und Tocilizumab empfohlen (letzteres stark bei früher diffuser SSc und Entzündung), Nintedanib bei Fibrose ≥10 % im HRCT (keine extra-pulmonale Beteiligung) und bei hohem Progressionsrisiko Nintedanib und MMF bzw. Immunsuppressiva (IS)-Kombinationen inkl. Cyclophosphamid (CYC) oder Rituximab (letztere bei schwerer Multiorganbeteiligung). Bei RA-ILD mit aktiver Arthritis werden Abatacept, Rituximab und JAK-Inhibitoren empfohlen, schwächer Tocilizumab, Glukokortikoide (GK), MMF und Azathioprin. Bei gut kontrollierter Arthritis werden bei schwerer bzw. progressiver ILD IS-Kombinationen empfohlen, bei progressiver Lungenfibrose Nintedanib allein oder mit IS-Kombinationen und bei UIP-Muster Pirfenidon.
Bei IIM-ILD werden primär GK, Calcineurin-Inhibitoren und Rituximab empfohlen, bei hohem Progressionsrisiko und/oder schwerer Organbeteiligung Kombinationen mit Hochdosis-GK, CYC, Rituximab, Calcineurin-Inhibitoren und IVIG, bei einer progressiven Lungenfibrose Nintedanib allein oder mit IS-Kombinationen und bei rasch-progressiver ILD (über Wochen oder wenige Monate) Hochdosis-GK plus CYC oder Rituximab mit Calcineurin-Inhibitoren; IVIG, JAK-Inhibitoren und eine Plasmapeherese können erwogen werden. Bei anderen CTD-ILD (SjD und MCTD; keine ausreichenden Erfahrungen bei SLE) gibt es lediglich schwache Empfehlungen für MMF, Azathioprin, GK, CYC und Rituximab (die beiden letzteren in Kombinationen bei hohem Progressionsrisiko und/oder schwerer Multiorganbeteiligung), bei progressiver Fibrose wiederum Nintedanib allein oder mit IS-Kombinationen.
Quelle: Session „EULAR Recommendations I“, 13. Juni 2025