Zunächst zur von Megan Clowse, Durham (USA), und Kollegen vorgestellten internationalen 48-wöchigen, randomisierten, placebokontrollierten Phase-III-Studie PHOENYCS GO zum Einsatz von Dapirolizumab pegol bei moderatem bis schwerem SLE. Dabei handelt es sich um ein neues, PEG-konjugiertes Fab-Fragment ohne Fc-Domäne, das an den CD40L bindet und bei SLE neben einer reduzierten B- und T-Zell-Aktivierung zu einer Herunterregulierung von Interferon (IFN)-Signalwegen führt.
Dapirolizumab pegol überzeugt in erster Phase-III-Studie
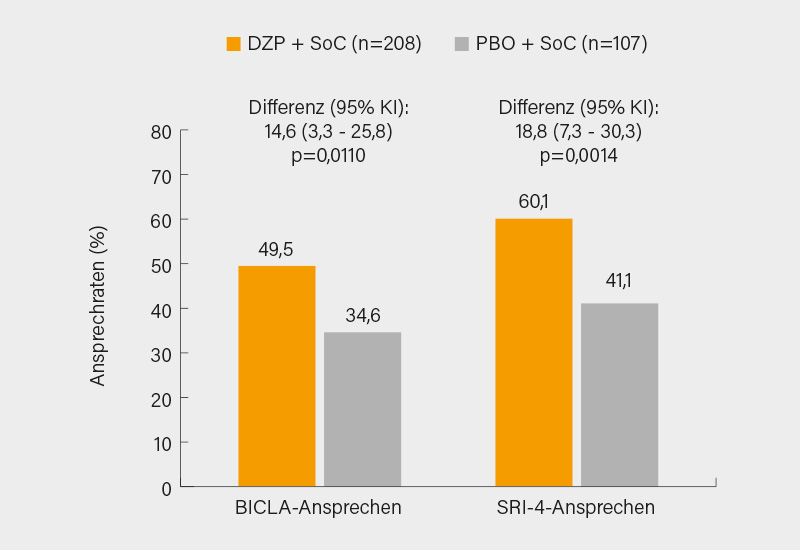
In die Studie eingeschlossen wurden 315 Patienten (im Mittel 42 Jahre, 93 % Frauen, mittlere Krankheitsdauer 10 Jahre) mit moderatem bis schwerem SLE (SLEDAI-2K-Score ca. 11; persistierende oder häufig fluktuierende Krankheitsaktivität mit Schüben) trotz stabiler Standardtherapie (SoC) einschließlich Antimalariamitteln (ca. 82 %), Glukokortikoiden (GK; 82 %) und Immunsuppressiva (IS; ca. 63 %). Die Teilnehmer wurden im Verhältnis 2:1 für 48 Wochen auf i.v. Dapirolizumab pegol (n=208) oder Placebo (n=107) alle 4 Wochen (jeweils plus SoC) randomisiert. Im Anschluss konnten die Patienten in eine Open-label-Extension übergehen. Primärer Endpunkt war (wie in den TULIP-Studien zu Anifrolumab) das BILAG-basierte Composite Lupus Assessment (BICLA)-Ansprechen zu Woche 48. Sekundäre Endpunkte umfassten das SLE Responder Index (SRI)-4-Ansprechen zu Woche 48 und die Prävention schwerer BILAG-Schübe bis zu Woche 48.
Insgesamt 90,1 bzw. 84,3 % der Dapirolizumab pegol oder Placebo (plus SoC) erhaltenden Patienten schlossen die Studie ab. Der primäre Endpunkt wurde erreicht: 49,5 vs. 34,6 % der Patienten zeigten ein BICLA-Ansprechen zu Woche 48 (p=0,0110; Δ14,6 %). Noch größer war die Differenz zugunsten von Dapirolizumab pegol im Hinblick auf das SRI-4-Ansprechen zu Woche 48 mit 60,1 vs. 41,4 % (nominal p=0,0014; Δ18,8 %) (Abb.). Mit 11,6 versus 23,4 % kam es unter Dapirolizumab pegol auch bei weniger Patienten zu schweren BILAG-Schüben bis Woche 48 (nominal p=0,0257; Δ11,5 %).
Per Protokoll musste bei Patienten mit einer GK-Dosis >7,5 mg/Tag Prednisonäquivalent bis spätestens Woche 8 ein Tapering auf ≤7,5 mg/Tag gestartet werden. Bei den Teilnehmern mit einer GK-Dosis >7,5 mg/Tag zu Baseline gelang unter Dapirolizumab pegol zu Woche 48 häufiger eine Steroidreduktion auf ≤7,5 mg/Tag (72,4 vs. 52,9 %, nominal p=0,0404; Δ17,1 %). Ein höherer Anteil der Patienten unter Dapirolizumab pegol hatte ≥1 therapieassoziiertes unerwünschtes Ereignis (TEAE; 82,6 vs. 75,0 %), jedoch waren schwerwiegende TEAE seltener (9,9 vs. 14,8 %). Zu opportunistischen Infektionen kam es bei 2,8 vs. 0,9 % der Studienteilnehmer. Bei Patienten mit prädisponierender Anamnese kam es zudem unter Dapirolizumab pegol zu einem thromboembolischen TEAE (Myokardinfarkt) und einem Todesfall (infolge einer Gangrän-assoziierten Sepsis). In Kombination mit einer SoC führte der CD40L-Inhibitor somit zu einem signifikanten Rückgang der Krankheitsaktivität (BICLA- und SRI-4-Ansprechen) und verbesserten GK-Tapering bei insgesamt guter Verträglichkeit. (1) Von einer Zulassung bei SLE ist man aber wohl noch mehrere Jahre entfernt, zunächst sind weitere Phase-III-Studien geplant, mit PHOENICS FLY wurde eine erste bereits initiiert.
Neues zu Anifrolumab und Ianalumab
Vor mehreren Jahren hatte eine kanadische Gruppe bereits Hinweise darauf gefunden, dass eine Langzeittherapie mit Belimumab im Vergleich zu einer alleinigen SoC langfristige Organschädigungen reduzieren könnte. Jetzt stellten Zahi Touma, Toronto (Kanada), mit der LASER-Studie einen solchen Vergleich für Anifrolumab vor.
354 Patienten der Phase-III TULIP-1/2-Studien, die Anifrolumab 300 mg erhalten hatten und (als externe Kontrolle) 561 Biologika-naive Patienten der University of Toronto Lupus Clinic (UTLC)-Kohorte (als SoC-Arm), die bezüglich der Einschlusskriterien jenen der TULIP-Studien entsprachen, gingen darin ein. Primärer Endpunkt war (in zwei Analysen) die mittlere Differenz im SLICC/ACR Damage Index (SDI) von Baseline bis Jahr 4. Beide Analysen zeigten für Anifrolumab signifikante Vorteile im primären Endpunkt (0,162 vs. 0,587, Δ-0,416 bzw. 0,224 vs. 0,561, Δ-0,337; je p<0,0001). Dies hatte auch nach Propensitiy-Score-Matching (je n=116) Bestand: 0,201 vs. vs. 0,571, Δ-0,370 (p=0,002). Patienten unter Anifrolumab hatten zudem ein um 59,9 % geringeres Risiko für eine erste SDI-Progression (Hazard Ratio, HR 0,401; p<0,01). Somit scheint auch Anifrolumab die Entwicklung irreversibler Organschäden zu verzögern. (2)
Auf dem EULAR und jetzt nochmal auf dem ACR vorgestellt wurden von Eduardo Mysler, Buenos Aires (Argentinien), und Kollegen die 68-Wochen-Daten einer randomisierten, doppelblinden, placebokontrollierten Phase-II-Studie zu dem BAFF-Rezeptor-Inhibitor Ianalumab, in der 67 Patienten mit moderatem bis schwerem SLE (im Mittel SLEDAI 2K 10, Prednison-Dosis 10 mg/Tag, Alter 40 Jahre, 88 % Frauen) für 28 Wochen 1:1 auf s.c. 300 mg Ianalumab 1x monatlich (n=34) oder Placebo (n=33) randomisiert wurden. In Woche 28 wechselten die Placebo-Patienten für 24 Wochen auf Ianalumab bis Woche 48, dem schloss sich eine Weiterbeobachtung (ohne Therapie) bis Woche 68 an. Den primären Endpunkt zu Woche 28 (SRI-4-Ansprechen plus Prednison-Tapering auf ≤5 mg/Tag oder ≤ Baseline-Dosis zu Woche 16 und Verbleiben darauf bis Woche 28) erreichten unter Ianalumab 44,1 vs. 9,1 % unter Placebo, ein isoliertes SRI-4-Ansprechen 70,6 vs. 24,2 %. Nach 52 Wochen erreichten 45,5 % der durchgehend mit und 40,6 % der in Woche 28 auf Ianalumab gewechselten Patienten den primären Endpunkt, ein SRI-4-Ansprechen je ca. 70 %.
Eine verlängerte Ianalumab-Exposition bis Woche 52 (vs. Woche 28) führte zur weiteren Verbesserung der Outcomes, so erreichten 61,8 % (vs. zuvor 50 %) ein SRI-6- und 35,3 (vs. 16,7 %) ein SRI-8-Ansprechen. Einen LLDAS erreichten 44,1 % (vs. zuvor 26,5 %), eine DORIS-Remission 32,4 % (vs. 14,7 %). Das Ansprechen blieb im Wesentlichen bis Woche 68 erhalten, es gab keine neuen Sicherheitssignale. Ianalumab war somit über 52 Wochen (und länger) sicher und wurde gut vertragen. Ein großes Phase-III-Studienprogramm (SIRIUS-SLE 1 & 2, and SIRIUS-LN) wurde bereits initiiert. (3)
Weitere potenzielle Therapiekandidaten
Keine konklusiven Ergebnisse lieferte eine von Arezou Khosroshah, Atlanta (USA), und Kollegen präsentierte Phase-II-Studie zu dem Anti-Immunoglobulin-Like Transcript 7 (ILT)-7-Antikörper Daxdilimab (der an plasmazytoiden dendritischen Zellen ansetzt). Der primäre Endpunkt (BICLA-Ansprechen plus GK-Reduktion) wurde nach 48 Wochen verfehlt. Ob der knapp signifikante Vorteil im Lupus Low Disease Activity State (LLDAS) und positive Trends z. B. beim SRI-Ansprechen eine weitere Exploration dieses Antikörpers bei SLE rechtfertigen, scheint eher zweifelhaft. (4) Erste positive Daten einer Phase-Ib-Studie stellten Torsten Witte, Hannover, und internationale Kollegen zu dem dualen Toll-Like Rezeptor 7/8 (TLR7/8)-Inhibitor Enpatoran bei SLE und kutanem LE vor (5), genaueres wird sich aber erst nach Abschluss der Phase-II-Studie WILLOW sagen lassen. Generell scheint dies aber ein eher vielversprechender Ansatz zu sein, eine Phase-II-Studie zu Afimetoran, einem weiteren TLR7/8-Inhibitor, bei aktivem SLE läuft bereits.
Update zur CAR-T-Zelltherapie und BiTE-Antikörpern
Mehrere Abstracts zur CAR-T-Zelltherapie präsentierten Georg Schett und Melanie Hagen, Erlangen, eines mit Interimsdaten zu 11 Patienten aus der Phase I/II CASTLE Basket-Studie (darunter 6 mit SLE) (6) und ein anderes zu 30 Patienten (18 mit SLE, 7 mit systemischer Sklerose und 5 mit entzündlicher Myositis), ebenfalls CASTLE-Daten mit einbeziehend. (7) Die (langfristige) Effektivität ist weiter ausgezeichnet, neue Sicherheitssignale gab es nicht. Erste positive Daten einer Phase-I-Studie zu bislang 4 SLE-Patienten stellte die Gruppe auch zu CC-97540, CD19-gerichteten chimären Nex-T CAR-T-Zellen, vor, von denen man sich einen schnelleren Herstellungsprozess und eine noch höhere Potenz erhofft. (8)
Dass bispezifische T-Cell-Enganger (BiTE)-Antikörper stetig wichtiger werden, unterstreicht eine chinesische Studie von Qiubai Li, Wuhan, und Kollegen zu A-319, einem CD3/CD19-BiTE, der erfolgreich und ohne Sicherheitsprobleme bei 6 refraktären SLE-Patienten eingesetzt wurde. (9)
Quellen:
1 Arthritis Rheumatol 2024; 76 (Suppl 9): Late-Breaking Abstr. L16
2 Arthritis Rheumatol 2024; 76 (Suppl 9): Late-Breaking Poster L13
3 Arthritis Rheumatol 2024; 76 (Suppl 9): Abstr. 2580
4 Arthritis Rheumatol 2024; 76 (Suppl 9): Abstr. 1542
5 Arthritis Rheumatol 2024; 76 (Suppl 9): Abstr. 1553
6 Arthritis Rheumatol 2024; 76 (Suppl 9): Abstr. 1750
7 Arthritis Rheumatol 2024; 76 (Suppl 9): Abstr. 1749
8 Arthritis Rheumatol 2024; 76 (Suppl 9): Abstr. 1753
9 Arthritis Rheumatol 2024; 76 (Suppl 9): Late-Breaking Poster L12