Nachdem vor einigen Jahren bereits die RepurpSS-I-Studie auf eine gute, signifikante Wirksamkeit der Leflunomid/HCQ-Kombination hingewiesen hatte (-4,35 Punkte im ESSDAI; p=0,0078), validierten jetzt niederländische Rheumatologen um Wing-Yi Wong, Utrecht, diese Befunde in der randomisierten, doppelblinden, placebokontrollierten Phase-IIb-Studie RepurpSS-II über 24 Wochen, gefolgt von einem Single-Arm-Crossover und einer offenen Verlängerung von 24 Wochen. Insgesamt 46 SjD-Patienten (2016er ACR/EULAR-Kriterien, 18-75 Jahre, ESSDAI-Score ≥5 Punkte) wurden im Verhältnis 1:1 auf Placebo (n=25) oder 1x täglich Leflunomid (20 mg)/HCQ (400 mg) (n=21) randomisiert (median 55 Jahre, 96 vs. 90,5 % Frauen, ESSDAI 9,9 vs. 9,5, ESSPRI 6,8 vs. 7,0). Primärer Endpunkt war die ESSDAI-Veränderung bis Woche 24 (adjustiert auf den Baseline-ESSDAI). Sekundäre Endpunkte waren adjustierte Veränderungen von Serum-IgG, C3, C4, RF, unstimuliertem Speichelfluss (UWS), Schirmer-Werten und ESSPRI nach 24 Wochen, erfasst wurden auch Komposit-Endpunkte (Sjögren’s Tool for Assessing Response [STAR] und Composite of Relevant Endpoints for Sjögren’s Syndrome [CRESS]) und PROs (ITT-Analyse).
Im primären Endpunkt bestätigten sich signifikante Vorteile der DMARD-Kombination versus Placebo mit einer mittleren ESSDAI-Abnahme bis Woche 24 um -4,13 Punkte (p=0,0016). Bei den sekundären Endpunkten wurden signifikante Verbesserungen mit Leflunomid/HCQ für die Serum-IgG- (-1,6; p=0,016), RF- (-8,7; p=0,013) und C4-Werte (0,021; p=0,031) beobachtet, nicht aber für die C3-Werte, UWS und Schirmer-Werte. Einen positiven Trend gab es im ESSPRI, signifikante Verbesserung zeigten sich im Ansprechen gemäß STAR (64 vs. 19 %; p=0,007) und CRESS (57 vs. 24 %; p=0,046). Die Inzidenz von Nebenwirkungen war in beiden Gruppen ähnlich, am häufigsten waren gastrointestinale Beschwerden (28,6 vs. 20,0 %). Insgesamt ein positives Ergebnis, ob diese Kombination auch bei Patienten mit hoher subjektiver Krankheitslast und geringer systemischer Krankheitsaktivität wirksam ist, müsste in weiteren Studien untersucht werden. (1)
FcRn-Inhibitor Efgartigimod überzeugt in Phase-II-Studie
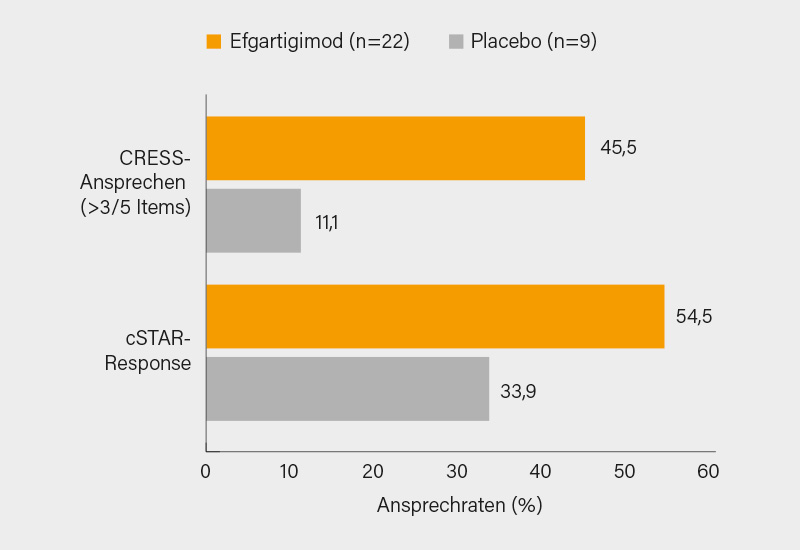
Das bislang in Studien gut verträgliche IgG1-Antikörper-Fc-Fragment Efgartigimod, das über die Hemmung des neonatalen Fc-Rezeptors (FcRn) selektiv IgG reduziert, wurde in der randomisierten, doppelblinden, placebokontrollierten Phase-II-Proof-of-Concept-Studie RHO getestet, die Isabelle Peene, Gent (Belgien), und internationalen Kollegen vorstellten. In die Studie wurden 31 SjD-Patienten eingeschlossen (ACR/EULAR-2016-Kriterien, ESSDAI-Score ≥5, Anti-Ro/SSA-positiv und erhaltener Speichelfluss) und im Verhältnis 2:1 für 24 Wochen auf 1x wöchentlich i.v. Efgartigimod oder Placebo randomisiert. Primärer Endpunkt war der CRESS (Ansprechen bei ≥3 von 5 Items) in Woche 24. Wichtige sekundäre Endpunkte waren der cSTAR, die Veränderung des ESSDAI- bzw. klinischen ESSDAI-Scores (ClinESSDAI) und des ESSPRI-Scores bis Woche 24 sowie die Sicherheit.
Der primäre Endpunkt wurde erreicht, mit einem Ansprechen bei ≥3 von 5 CRESS-Items in der Efgartigimod-Gruppe von 45,5 % (10/22) der Patienten im Vergleich zur Placebo-Gruppe mit 11,1 % (1/9) in Woche 24 (Abb.). Für 4 der 5 CRESS-Items (systemische Krankheitsaktivität: 59,1 vs. 33,3 %, Speicheldrüsenfunktion: 36,4 vs. 22,2 %, Tränendrüsenfunktion: 27,3 vs. 11,1 % und Serologie: 86,4 vs. 11,1 %) wurde ein besseres Ansprechen auf Efgartigimod versus Placebo beobachtet. Mit 54,5 % (12/22) erreichten in Woche 24 auch mehr Teilnehmer unter Efgartigimod versus 33,3 % (3/9) unter Placebo eine cSTAR-Response (Abb.). Starke Verbesserungen der Krankheitsaktivität (ESSDAI und ClinESSDAI) wurden in beiden Behandlungsgruppen festgestellt. Keine relevanten Veränderungen waren im ESSPRI erkennbar. Efgartigimod wurde gut vertragen, neue Sicherheitssignale blieben aus. IgG- und Anti-Ro52-Autoantikörper wurden ab Woche 4 rasch um im Mittel 58,3 % bzw. 63,8 % reduziert. Entsprechend zeigte der C1Q-Immunkomplex eine Reduktion um 4,0 mg Eq/ml nach 4 Wochen, während keine Wirkung im Placebo-Arm beobachtet wurde. Bis zum Studienende wurde der RF um 19,6 % (Efgartigimod) gegenüber 6,3 % (Placebo) reduziert.
Die Proof-of-Concept-Studie zeigte somit, dass Efgartigimod (wie zuvor Nipocalimab, das jetzt in Phase-III geprüft wird) bei Patienten mit primärer SjD sicher und wirksam ist. Die Phase-III-Studie UNITY zum Einsatz von Efgartigimod bei Patienten mit primärer SjD und moderater bis schwerer systemischer Krankheitsaktivität (ClinESSDAI ≥6) ist bereits angelaufen. (2) Weitere Studien zu dem bei Myasthenia gravis und chronisch inflammatorischer demyelinisierender Polyneuropathie (CIDP) bereits zugelassenen Antikörper laufen derzeit bei Patienten mit Myositis (Phase-III) und systemischer Sklerose (Phase-II).
Inwieweit das mit einem ähnlichen Wirkmechanismus aufwartende Nipocalimab bei primärer SJD (die Phase-II-Daten der DAHLIAS-Studie waren vielversprechend) und in anderen rheumatologischen Indikationen weiterentwickelt wird, scheint noch nicht festzustehen.
Quellen:
1 Ann Rheum Dis 2025; 84 (Suppl 1): 317 (LB0005)
2 Ann Rheum Dis 2025; 84 (Suppl 1): 37 (OP0041)