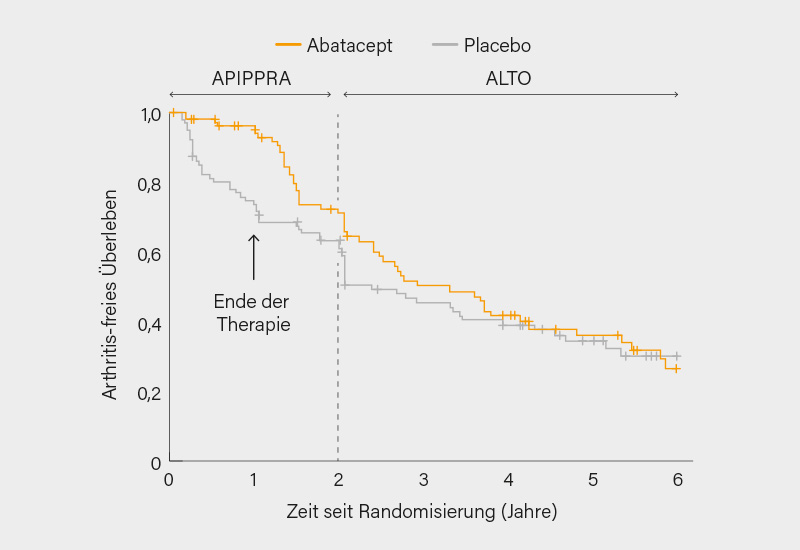
Zunächst zur von Andrew Cope, London (Großbritannien), und Kollegen vorgestellten ALTO-Studie, einer Fortsetzung der randomisierten, doppelblinden, placebokontrollierten Phase-IIb-Studie APIPPRA, in der 213 ACPA+/RF+- oder ACPA hoch/RF--Teilnehmer mit einer entzündlichen Arthralgie, aber ohne klinische Synovitis, im Verhältnis 1:1 für 52 Wochen auf s.c. Abatacept 125 mg oder Placebo randomisiert wurden (mit anschließend 52-wöchigem Follow-up), primärer Endpunkt war die Zeit bis zum Auftreten einer klinischen Synovitis in ≥3 Gelenken oder RA gemäß den ACR/EULAR-2010-Klassifikationskriterien.
Langzeitdaten aus drei RA-Präventionsstudien
In ALTO gingen 143 Teilnehmer ein (71 aus der Abatacept- und 72 aus der Placebo-Gruppe; im Mittel 48 Jahre, 78 % Frauen), das mittlere Follow-up erstreckte sich über 66 Monate. Nach dem ersten Jahr erreichten 6 vs. 29 % den primären Endpunkt, nach 2 Jahren 30 vs. 40 %, nach 3 und 4 Jahren betrug die Differenz nur noch 4 bzw. 2 % (Abb.). Die Differenz im Arthritis-freien Überleben betrug nach 2, 3 und 4 Jahren 3,3 (p=0,001), 4,4 (p=0,008) und 5,0 Monate (p=0,039); nach 5 Jahren gab es keinen signifikanten Unterschied mehr (5,2 Monate; p=0,102).
In einer Subgruppe mit hohem ACPA ≥340 IU/ml entwickelten nach 2 bzw. 4 Jahren 27 vs. 49 % bzw. 59 vs. 67 % eine Arthritis, in einer anderen mit erweitertem Serotyp (IgG-ACPA, IgA-ACPA, Anti-CarP, AAPA und RF; „5 Serotypen“) 12 vs. 53 % bzw. 47 vs. 67 %. Fazit: Eine 1-jährige Abatacept-Gabe verzögert das Fortschreiten zur RA um bis zu 3 Jahre nach Therapieende, dies besonders bei hohem Risiko (hohes ACPA, 5 Serotypen). (1)
Weitere Langzeitdaten über bis zu 9 Jahre aus der ähnlichen ARIAA-Studie mit 6-monatiger Abatacept-Gabe bei ACPA-positiven Teilnehmern mit Gelenkschmerzen und subklinischer Entzündung im Hand-MRT präsentierte Koray Tascilar, Erlangen. Nach 6 und 18 Monaten zeigte sich ein signifikanter Vorteil von Abatacept versus Placebo in puncto RA-Entwicklung (8 vs. 35 % bzw. 35 vs. 57 %), dieser war bis zu Jahr 5 nachweisbar, anschließend schloss sich die Lücke. Im Mittel verschaffte die Frühintervention mit Abatacept den Teilnehmern (insgesamt 98 wurden eigeschlossen) 10 zusätzliche RA-freie Monate. (2)
Die 5-Jahres-Daten der TREAT EARLIER-Studie zu einer 1-jährigen Methotrexat (MTX)-Therapie bei ACPA-positiven und -negativen Arthralgie-Patienten stellte Hanna W. van Steenbergen, Leiden (Niederlande), vor: Während bei ACPA-positiven Teilnehmern kein anhaltender Effekt von MTX erkennbar war, profitierte die ACPA-negative Subgruppe signifikant: Im Vergleich zu Placebo entwickelten unter MTX nach 5 Jahren 9 vs. 32 % (p=0,018) eine RA. (3) Letztlich liegt solch eine Frühintervention weiter im ärztlichen Ermessen, in Ermangelung formaler Leitlinien bieten aktuelle EULAR/ACR-Kriterien zur Risikostratifizierung bei klinisch suspekter Arthralgie eine gewisse Hilfestellung (Cave: Morgensteifigkeit, Gelenkschwellung, Probleme eine Faust zu machen, hohes CRP, RF+, ACPA+). (4)
Neuroimmunmodulation mittels Vagusnervstimulation
Bereits vom ACR bekannt waren die von John Tesser, Phoenix (USA), und Kollegen vorgestellten Daten der randomisierten, doppelblinden, Sham-kontrollierten RESET-RA-Studie, in der bei 242 Patienten mit moderater bis schwerer RA und unzureichendem Ansprechen oder Intoleranz von ≥1 b- oder tsDMARD (≥2 bei >60 %) ein implantierbares zervikales Vagusnervstimulations-Device über 12 Wochen gegen eine Kontrollstimulation im Verhältnis 1:1 geprüft wurde (im Mittel 56 Jahre, 86 % Frauen, Krankheitsdauer 12 Jahre). Alle Patienten blieben auf einer stabilen csDMARD-Therapie, b/tsDMARDs wurden vor der Implantation „ausgewaschen“. Ab Woche 12 bis 24 erfolgte ein Open-label-Crossover auf die aktive Stimulation. Beim primären Endpunkt, dem ACR20-Ansprechen zu Woche 12, fand sich mit 35,2 vs. 24,2 % ein signifikanter Vorteil des aktiven Device (p=0,0209), bis Woche 24 steigerte sich die ACR20-Response auf 51,5 % bei fortgeführter aktiver Stimulation und 53,1 % nach dem Wechsel auf diese. In einer Sekundäranalyse betrug das ACR20-Ansprechen zu Woche 12 bei bDMARD-erfahrenen Patienten 44,2 vs. 19,0 % (p=0,0054). Alle sekundären (z. B. DAS28-CRP-Remission/LDA) und explorativen Endpunkte zeigten positive Trends oder signifikante Vorteile für die aktive Stimulation, das Sicherheitsprofil war gut. Das Verfahren bietet sich womöglich bei therapierefraktärer RA als Add-on-Behandlung an, eine US-Zulassung seitens der FDA ist inzwischen erfolgt. (5)
JAK-Inhibition: Die Suche nach mehr Sicherheit
Eine Möglichkeit, das vermeintlich mit JAK-Inhibitoren erhöhte kardiovaskuläre Risiko zu minimieren, könnte in deren Kombination mit der Rho-Kinase (ROCK)-Hemmung bestehen. Polnische Experten um Bartłomiej Kisiel, Warschau, stellten auf dem EULAR (fast parallel im Lancet publiziert) eine 12-wöchige, randomisierte, doppelblinde, placebokontrollierte Phase-II-Studie zu dem dualen JAK/ROCK-Inhibitor CPL’116 bei 106 Patienten mit moderater bis schwerer RA und Versagen auf MTX vor (im Mittel 54,4 Jahre, 75 % Frauen; 99 schlossen die Studie ab). Diese wurden im Verhältnis 1:1:1:1 auf 2x täglich orales CPL’116 60, 120 oder 240 mg oder Placebo randomisiert. Bei bis dato guter Verträglichkeit kam es zu einer dosisabhängigen Verbesserung des DAS28-CRP nach 12 Wochen, die für die 240 mg-Dosis versus Placebo signifikant war (Δ -0,887; p=0,01). Die Remissionsrate (DAS28-CRP<2,6) für die 240 mg-Dosis lag im gesamten Verlauf über 45 %. Auch in anderen Endpunkten zeigten sich Vorteile vor allem der 240 mg-Dosis. Blutwerte wie Lipide, ALT, AST, CK, Erythrozyten- und Thrombozytenzahl, Hämatokrit und Hämoglobin wurden unter CPL‘116 nicht signifikant verschlechtert – ein Vorteil gegenüber klassischen JAK-Inhibitoren. Weitere Daten zu Effektivität und (kardiovaskulärer) Sicherheit bleiben aber zunächst abzuwarten. (6, 7)
Das in ORAL-Surveillance unter JAK- (Tofacitinib) im Vergleich zu TNF-Inhibitoren ermittelte erhöhte Malignitätsrisiko bestätigte sich in der großen, von Romain Aymon, Genf (Schweiz), vorgestellten „JAK-POT“-Real-World-Studie (13 RA-Register aus Europa und Quebec mit 33.127 Patienten) nicht. 638 Krebsfälle ohne nicht-melanozytärem Hautkrebs (NMSC) und 219 NMSC wurden verzeichnet. Die krude Krebsinzidenz (ohne NMSC) war niedriger für TNF- (2,2/1.000 Patientenjahre, PJ) als JAK-Inhibitoren (2,9/1.000 PJ) und bDMARDs mit anderem Wirkmechanismus (OMA; 3,1/1.000 PJ). Eine adjustierte Regressionsanalyse fand keine signifikante Diifferenz in der Krebsinzidenz ohne NMSC (aIRR 1,10) oder NMSC (aIRR 1,12) zwischen JAK- und TNF-Inhibitoren oder JAK-Inhibitoren and OMA-bDMARDs (aIRR 1,07 bzw. 0,79). Die Hochrisiko-Kohorte (die ORAL Surveillance-Einschlusskriterien erfüllend; 39,4 %) wies zwar eine höhere Krebsinzidenz auf (OMA 4,1/1.000 PJ, JAK 4,2/1.000 PJ, TNF 3,2/1.000 PJ), es fand sich aber keine signifikante Differenz in der Krebsinzidenz ohne NMSC (aIRR 1,16) und für NMSC (aIRR 1,15) zwischen JAK- und TNF-Inhibitoren oder zwischen JAK-Inhibitoren and OMA-bDMARDs (aIRR 1,09 bzw. 0,92). (8)
Dieser Befund könnte aber auch auf ein nicht ausreichend langes Follow-up zurückzuführen sein, wie aktuelle Daten aus dem RABBIT-Register verdeutlichen, wo sich eine höhere Krebsinzidenz unter JAK-Inhibitoren gegenüber TNF-Inhibitoren bzw. anderen bDMARDs erst ab einer Therapiedauer von >16 Monaten fand. (9)
Quellen:
1 Ann Rheum Dis 2025; 84 (Suppl 1): 4 (OP0004)
2 Ann Rheum Dis 2025; 84 (Suppl 1): 262 (OP0325)
3 Ann Rheum Dis 2025; 84 (Suppl 1): 260 (OP0324)
4 Ann Rheum Dis 2025; doi: 10.1016/j.ard.2025.01.021
5 Ann Rheum Dis 2025; 84 (Suppl 1): 157 (OP0190)
6 Ann Rheum Dis 2025; 84 (Suppl 1): 160 (OP0193)
7 Lancet Rheumatol 2025; doi: 10.1016/S2665-9913(25)00060-8
8 Ann Rheum Dis 2025; 84 (Suppl 1): 193 (OP0232)
9 Ann Rheum Dis 2025; doi: 10.1016/j.ard.2025.05.014