In die Pathogenese der RZA sind T-Helfer (Th)1 und Th17-Lymphozyten involviert. Sowohl Glukokortikoide (GK) als auch der IL-6-Rzeptorinhibitor Tocilizumab zielen vorrangig auf Th17-Achse ab, während eine substanzielle residuale Th1-Aktivität bestehen bleibt. Bereits präklinische Studien hatten gezeigt, dass GM-CSF, ein Upstream-Mediator von sowohl Th1- als auch Th17-Zellen, bei RZA ein pathogener Faktor ist. Dies war der Ausgangspunkt für diese internationale Phase-II-Studie zur Effektivität und Sicherheit von Mavrilimumab in der Remissionserhaltung.
Signifikante Vorteile in der Remissionserhaltung
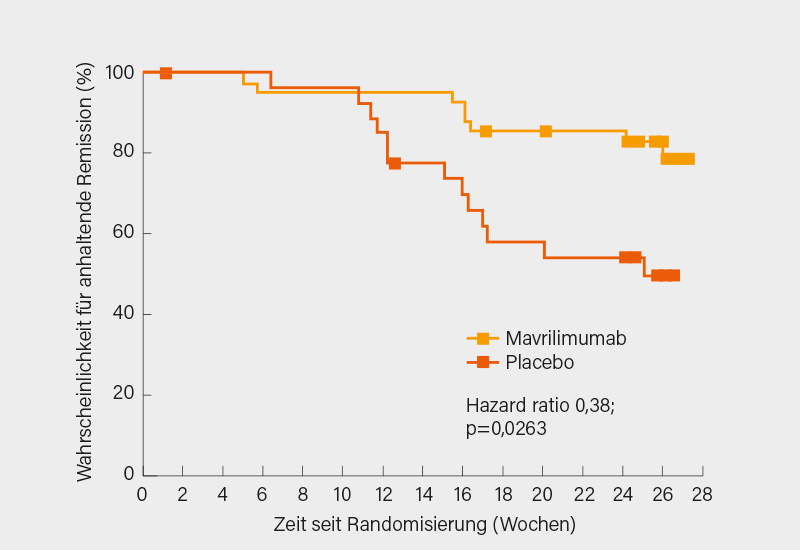
In der Studie wurden 70 Patienten mit einer seit 6 Wochen vor dem Studieneinschluss aktiven (RZA-Symptome und ESR ≥30 mm/h oder CRP-Erhöhung ≥1 mg/dl) de-novo oder rezidivierenden RZA (je 35 Teilnehmer; bestätigt entweder durch Temporalarterienbiopsie oder vaskuläre Bildgebung; 71 % Frauen, im Mittel 70 Jahre) im Verhältnis 3:2 (n=42 vs. n=28) auf s.c. Mavrilimumab 150 mg oder Placebo alle 2 Wochen zusätzlich zu einem Protokoll-gemäßen 26-wöchigen Prednison-Tapering (ausgehend von 20-60 mg/Tag) randomisiert. Zu Baseline musste verpflichtend eine GK-induzierte Krankheitsremission (Resolution der RZA-Symptomatik und CRP <1 mg/dl oder ESR <20 mm/h) erreicht sein. Primärer Wirksamkeits-Endpunkt war die Zeit bis zum ersten Schub zu Woche 26 in allen Patienten (modifizierte ITT-Population). Ein Schub, bestätigt durch ein unabhängiges Komitee, war definiert als ESR ≥30 mm/h und/oder CRP ≥1 mg/dl und neuerliche RZA-Symptome oder eine neue bzw. sich verschlechternde Vaskulitis in der Bildgebung. Ein präspezifizierter sekundärer Endpunkt war eine anhaltende Remission bis Woche 26 gemäß Kaplan-Meier-Schätzung.
Zu einem Krankheitsschub bis Woche 26 kam es unter Mavrilimumab und Placebo bei 19,0 bzw. 46,4 % der Patienten (Δ27,4 %). Die mediane Zeit bis zu einem Schub bis Woche 26 konnte für Mavrilimumab aufgrund zu weniger Ereignisse nicht berechnet werden und betrug 25,1 Wochen im Placeboarm (Hazard ratio, HR 0,38, 95% KI 0,15-0,92; p=0,0263) (Abb.). Eine bis Woche 26 anhaltende Remission erreichten unter Mavrilimumab und Placebo 83,2 gegenüber 49,9 % der Studienteilnehmer (Δ33,4 %; p=0,0038). Die Ergebnisse waren konsistent in den beiden Subgruppen (HR für Schub bei de-novo-Patienten 0,29, 95% KI 0,06-1,31; nominal p=0,0873; HR für Schub bei rezidivierenden/refraktären Patienten 0,43, 95% KI 0,14-1,30; nominal p=0,1231).
Unerwünschte Ereignisse (UE), meistens mild bis mäßig ausgeprägt, waren vergleichbar in beiden Studienarmen (78,6 vs. 89,3 %). Es kam bei 4,8 vs. 10,7 % der Patienten zu schweren UE, die aber nicht der Therapie zugerechnet wurden. Es gab keine Todesfälle, auch kam es zu keinem Visusverlust. Unter dem monoklonalen Anti-GM-CSF-Antikörper (der auch bei rheumatoider Arthritis und zuletzt COVID-19 geprüft wurde) wurden keine neuen Sicherheitssignale berichtet.
Im Ergebnis zeigte sich Mavrilimumab in der Remissionerhaltung somit im Vergleich zu Placebo signifikant überlegen mit einer bis Woche 26 nur geringen Schubrate – eine längere Nachbeobachtung zur Quantifizierung des steroidsparenden Effekts wäre sinnvoll. Aufgrund der guten Verträglichkeit wäre eine Weiterentwicklung von Mavrilimumab bei RZA wünschenswert gewesen, Ende Februar zog der Hersteller jedoch seine Pläne für eine Phase-III-Studie zurück.
Quelle: Ann Rheum Dis 2022: doi: 10.1136/annrheumdis-2021-221865