Bimekizumab hatte in den randomisierten, doppelblinden, placebokontrollierten Phase-III-Studien BE MOBILE 1 (nr-axSpA) and BE MOBILE 2 (r-axSpA) nach 16 Wochen seine Wirksamkeit unter Beweis gestellt. Jetzt berichtet eine internationale Studiengruppe um Xenofon Baraliakos, Bochum/Herne, über die 52-Wochen-Daten beider Studien. Auf die 16-wöchige doppelblinde, placebokontrollierte Phase folgte eine 36-wöchige Bimekizumab-Fortführungsphase (BE MOBILE 1: n=128; BE MOBILE 2: n=221) und die Placebo-Patienten wurden in Woche 16 auf Verum umgestellt und erhielten danach ebenfalls s.c. Bimekizumab 160 mg alle 4 Wochen (BE MOBILE 1: n=126; BE MOBILE 2: n=111).
Bimekizumab: Noch ansteigende Wirksamkeit
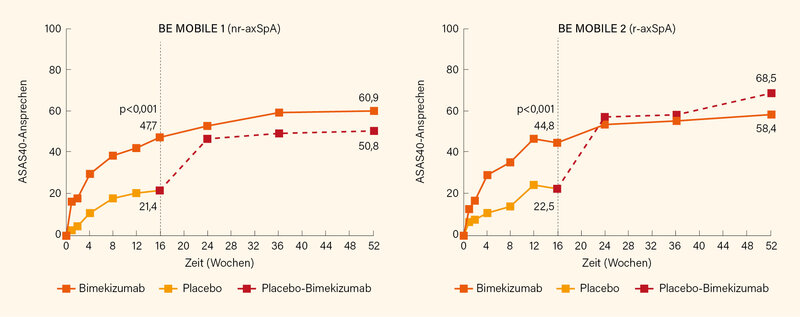
In Woche 16 hatten in BE MOBILE 1 (nr-axSpA) 47,7 vs. 21,4 % (p<0,001) der Patienten unter Bimekizumab bzw. Placebo den primären Endpunkt eines ASAS40-Ansprechens erreicht. Unter Beibehaltung von Bimekizumab stieg dieser Anteil bis Woche 52 auf 60,9 %, auch 50,8 % der erst in Woche 16 auf Bimekizumab eingestellten Patienten erreichten dieses Kriterium in Woche 52 (Abb. li.). Auch im Hinblick auf sekundäre Endpunkte zeigte sich eine anhaltende und meist noch steigende Wirksamkeit bis Woche 52, ab Woche 16 auf Bimekizumab gewechselte Patienten erreichten ein ähnlich gutes Ansprechen (auch mit einem TNFα-Inhibitor vorbehandelte Teilnehmer schnitten vergleichbar gut ab wie zuvor TNF-naive). So erreichten unter Bimekizumab bzw. Placebo/Bimekizumab eine ASAS-PR (partielle Remission) 29,7 bzw. 30,2 %, eine ASDAS-MI (major improvement) 36,7 bzw. 29,4 %, eine ASDAS-LDA (low disease activity, <2,1) 61,6 bzw. 54,5 %, eine ASDAS-ID (inactive disease, <1,3) 25,2 bzw. 28,0 % und ein BASDAI50-Ansprechen 53,9 bzw. 49,2 %. Die Verbesserungen im hs-CRP und der MRT-Entzündung der Sakroiliakalgelenke (SIG)/Wirbelsäule blieben bis Woche 52 erhalten – dies gilt ebenso für die BE MOBILE 2-Studie (r-axSpA). In dieser hatten in Woche 16 unter Bimekizumab bzw. Placebo 44,8 vs. 22,5 % (p<0,001) den primären Endpunkt ASAS40-Ansprechen erreicht, unter fortgeführter Bimekizumab-Therapie stieg dieser Anteil bis Woche 52 auf 58,4 %, sogar 68,5 % der ab Woche 16 Bimekizumab erhaltenden Patienten erreichten dieses Kriterium in Woche 52 (Abb. re.). Ferner erreichten unter Bimekizumab bzw. Placebo/Bimekizumab in Woche 52 29,9 bzw. 36,9 % der Studienteilnehmer eine ASAS-PR, 32,1 bzw. 44,1 % eine ASDAS-MI, 57,1 bzw. 66,4 % eine ASDAS-LDA, 23,4 bzw. 37,1 % eine ASDAS-ID und 53,8 bzw. 62,2 % ein BASDAI50-Ansprechen.
Bis Woche 52 wurde ≥1 therapieassoziiertes unerwünschtes Ereignis (TEAEs) bei 183 (75,0 %) und 249 (75,5 %) Patienten mit nr-axSpA bzw. r-axSpA verzeichnet, die mindestens eine Bimekizumab-Dosis erhalten hatten. Schwere TEAEs traten bei 9 (3,7 %) der Patienten mit nr-axSpA und 20 (6,1 %) jener mit r-axSpA auf. Eine orale Candidiasis war die häufigste Pilzinfektion (nr-axSpA: 18 [7,4 %]; r-axSpA: 20 [6,1 %]). Diese waren aber (abgesehen von einem schwereren Fall) nicht-systemisch und lokalisiert und führten nur bei 5 Patienten zu einem Therapieabbruch. Eine Uveitis trat bei 3 (1,2 %) und 7 (2,1 %) Patienten mit nr-axSpA und r-axSpA auf, entzündliche Darmerkrankungen bei 2 (0,8 %) und 3 (0,9 %). Es wurden keine relevanten Sicherheitssignale in puncto kardiovaskulärer Ereignisse oder Malignitäten verzeichnet. Bei anhaltend guter Wirksamkeit bestätigte sich somit das auch aus anderen Indikationen bekannte Sicherheitsprofil des IL-17A/F-Inhibitors. (1)
Upadactinib: Anhaltend effektiv und sicher
Upadacitinib hatte seine Effektivität und ein akzeptables Sicherheitsprofil bei Patienten mit r-axSpA und später auch nr-axSpA im Phase-III-SELECT-AXIS-Programm demonstriert. Wiederum eine Studiengruppe um Xenofon Baraliakos publizierte nun die 1-Jahres-Daten zu r-axSpA-Patienten mit unzureichendem Ansprechen auf Biologika (bDMARD-IR) aus der randomisierten, doppelblinden, placebokontrollierten SELECT-AXIS 2-Studie. In dieser waren die Patienten für 14 Wochen auf Upadacitinib 15 mg (1x täglich) oder Placebo randomisiert worden und konnten danach an einer Open-label-Extension (über bis zu 2 Jahre) teilnehmen und die Therapie mit dem JAK-1-Inhibitor fortführen oder auf diesen wechseln. Primärer Endpunkt war ebenfalls das ASAS40-Ansprechen, auch Subgruppenanalysen (Wirkverlust vs. Intoleranz des bDMARDs, vorherige TNFα- vs. IL-17A-Inhibitor-Exposition) wurden durchgeführt.
Von 420 randomisierten Patienten schlossen 366 (kontinuierlich Upadacitinib: n=181; Placebo/Upadacitinib: n=185) die Behandlung über 52 Wochen ab. In Woche 52 wurde unter kontinuierlichem Upadacitinib bzw. Placebo/Upadacitinib ein ASAS40-Ansprechen von 66 bzw. 65 %, eine ASDAS LDA von 57 bzw. 55 % und eine ASDAS-ID von 26 bzw. 25 % der Patienten erreicht. Die Verbesserungen im Hinblick auf Rückenschmerzen, nächtliche Rückenschmerzen und BASFI betrugen -4,5 bzw. -4,3, -4,6 bzw. -4,4 und -3,6 bzw. -3,5. Für den primären sowie sekundäre Endpunkte zeigte sich somit ein im Verlauf bis Woche 52 noch zunehmendes Ansprechen, die ab Woche 14 auf Upadacitinib gewechselten Patienten schnitten vergleichbar gut ab wie die durchgehend damit behandelten. Die Ergebnisse der Subgruppenanalysen waren konsistent mit jenen der Gesamtpopulation. Neue Sicherheitssignale wurden nicht identifiziert. Damit zeigte Upadacitinib eine bis Woche 52 anhaltende Verbesserung der Beschwerden bei bDMARD-IR r-axSpA-Patienten, wobei die Wirksamkeit vergleichbar war zwischen Teilnehmern mit Wirkverlust oder Intoleranz des/der bDMARDs oder bei vorheriger Anti-TNFα- oder -IL-17A-Exposition. (2)
Quellen:
1 Ann Rheum Dis 2023; doi: 10.1136/ard-2023-224803
2 Arthritis Res Ther 2023; 25(1): 172