Zunächst zu den mit heißer Nadel gestrickten, noch nicht abschließend konsentierten EULAR-Empfehlungen zum Management der PsA, deren aktueller, noch vorläufiger Stand auf einer Leitlinien-Session von Laure Gossec, Paris (Frankreich), vorgetragen wurde. Während sich die übergreifenden Prinzipien kaum ändern – es wird jetzt noch stärker der Augenmerk auf die unterschiedlichen PsA-Manifestationen gerichtet – gibt es bei den spezifischen Empfehlungen ein gewisses Abrücken von der rein hierarchischen Struktur hin zu einem (wie bei der GRAPPA) stärker Domänen-orientierten Ansatz, der zwar die Haut etwas außen vor lässt, aber stärker zwischen Oligo- und Polyarthritis, enthesialer und axialer PsA differenziert. Bei Polyarthritis wird als erstes csDMARD eindeutig Methotrexat (MTX) präferiert, nach csDMARD-Versagen, egal ob bei Poly- oder Oligoarthritis, sind bDMARDs gefragt, bei relevanter Hautbeteiligung gibt es eine Präferenz für IL-17- oder IL-12/23-Inhibitoren. Führen cs- und bDMARDs nicht zum Erfolg, wird zu JAK-Inhibitoren geraten. Bei milder Erkrankung wird nach csDMARD-Versagen, wenn bDMARDs unangemessen erscheinen, Apremilast empfohlen. Bei Enthesitis und axialer PsA werden nach NSAR bDMARDs empfohlen, bei axialer Beteiligung präferenziell TNFα-Inhibitoren (bei relevanter Psoriasis kommen wieder eher IL17- und ggf. IL-12/23-Hemmer ins Spiel). Auch zum Tapering oder zur Situation nach bDMARD- (und ggf. tsDMARD)-Versagen gibt es Hinweise. Auf die Vollpublikation mit einem deutlich veränderten Therapiealgorithmus, mit der aber wohl frühestens Ende des Jahres oder wahrscheinlicher in 2020 zu rechnen ist, kann man gespannt sein.
SPIRIT-H2H: Vorteile von Ixekizumab versus Adalimumab
Die Ergebnisse der mit Spannung erwarteten 52-wöchigen, randomisierten, open-label, Studienarzt-verblindeten, Parallelgruppenstudie SPIRIT-H2H zum Head-to-head-Vergleich des IL-17A-Inhibitors Ixekizumab mit dem etablierten TNFα-Inhibitor Adalimumab stellte Philip J. Mease, Seattle (USA), als Late breaking-Abstract vor. In die Studien waren 566 Patienten (mittleres Alter 48 Jahre, Krankheitsdauer ca. 6 Jahre) mit aktiver PsA (≥3 TJC + ≥3 SJC; im Mittel SJC 10, TJC 20) und Plaque-Psoriasis (≥3 % Körperoberfläche, BSA; mittlerer PASI knapp 8) eingeschlossen worden, die noch bDMARD-naiv waren und auf eine csDMARD-Therapie nur unzureichend angesprochen hatten (ca. 70 % erhielten eine Begleittherapie mit einem csDMARD, in der Regel war dies MTX). Die Patienten wurden im Verhältnis 1:1 für 52 Wochen auf Ixekizumab oder Adalimumab randomisiert, wobei die Höhe bzw. Frequenz der jeweiligen On-label-Dosierung auf dem Vorliegen oder Nicht-Vorliegen einer mäßigen bis starken Psoriasis ausgerichtet wurde. Primärer Endpunkt war der Nachweis der Überlegenheit von Ixekizumab versus Adalimumab im gleichzeitigen Erreichen eines ACR50- und PASI 100-Ansprechens in Woche 24. Wichtige sekundäre Endpunkte waren wiederum in Woche 24 der Nachweis der Nicht-Unterlegenheit von Ixekizumab im ACR50-Ansprechen (Nicht-Unterlegenheits-Marge -12 %) und einer Überlegenheit beim Erreichen des PASI 100-Kriteriums.
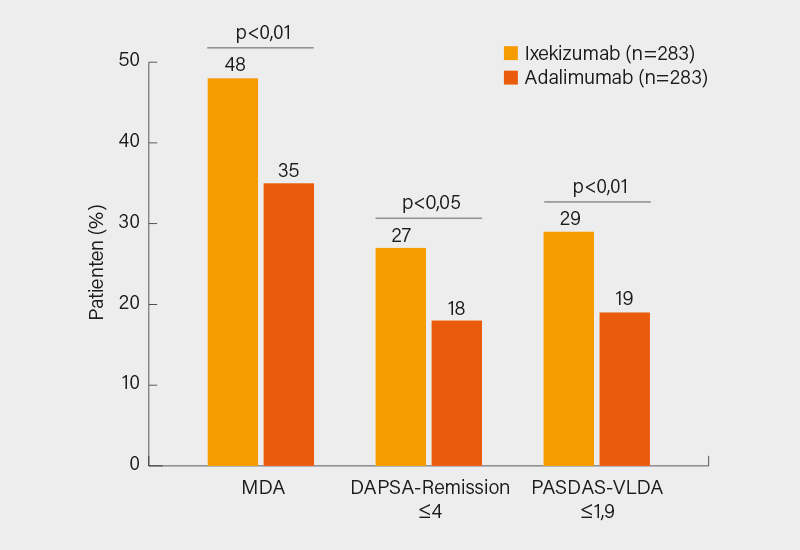
Alle primären und die wichtigsten sekundären Endpunkte wurden von Ixekizumab erfüllt: So erreichten 36 vs. 28 % der Patienten in Woche 24 ein kombiniertes ACR50- und PASI 100-Ansprechen (p<0,05), demonstriert wurde auch die Nicht-Unterlegenheit im ACR50- (51 vs. 47 %) und Überlegenheit beim PASI 100-Ansprechen (60 vs. 47 %; p<0,01). Auf Augenhöhe waren die beiden bDMARDs in Woche 24 auch in puncto ACR20/70, Daktylitis (LDI-Basic), signifikante Vorteile bot Ixekizumab jedoch im PASI75/90 sowie bei der vollständigen Resolution der Enthesitis (SPARCC Enthesitis-Index =0: 57 vs. 45 %; p<0,05) sowie im Hinblick auf mehrere, die PsA-Manifestationen in der Gesamtheit besser abdeckenden Komposit-Scores. So erreichten mit 48 vs. 35 % signifikant mehr der mit Ixekizumab behandelten Teilnehmer das Treat-to-target (T2T)-Zielkriterium einer minimalen Krankheitsaktivität (MDA; p<0,01) sowie eine DAPSA-Remission ≤4 (27 vs. 18 %; p<0,05) und PASDAS-VLDA ≤1,9 (29 vs. 19 %; p<0,01) (Abb. 1). Gerade diese Befunde liefern letztlich gute Argumente zugunsten des IL-17A-Inhibitors, vor allem dann, wenn eine relevante Psoriasis und/oder eine Enthesitis vorliegen, zumal keine neuen Sicherheitssignale erkennbar waren. (1)
Alles in Allem boten diese Ergebnisse beim Quervergleich der bisherigen Studien keine große Überraschung, wobei die Wahl des strengen Outcome-Kriteriums durchaus Lob verdient, selbst wenn durch die PASI 100-Komponente der Ausgang natürlich in Richtung Ixekizumab beeinflusst wurde. Interessant wird sein, wie die derzeit noch laufende Head-to-head-Studie EXCEED von Secukinumab versus Adalimumab ausgehen wird, wo der primäre Endpunkt tatsächlich rein auf die Gelenke abzielt, wenn auch mit der hohen 300 mg-Dosis von Secukinumab und dem weniger ambitionierten ACR20-Ansprechen in Woche 52 als Zielkriterium.
Axiale PsA: Secukinumab punktet in MAXIMISE-Studie
In Sachen Secukinumab sei zunächst kurz auf die ebenfalls von Philip J. Mease als Late breaker vorgestellten, anhaltend positiven 2-Jahres-Daten aus der FUTURE 5-Studie sowohl zum klinischen Ansprechen als auch zur Hemmung der radiologischen Progression verwiesen. Bei 89,5 % der mit Secukinumab 300 mg über zwei Jahre behandelten PsA-Patienten kam es zu keiner radiologischen Progression (mTSS <0,5), unter der 150 mg-Dosierung bei 82,3 %. 77 bzw. 51,9 % erreichten unter 300 mg Secukinumab nach zwei Jahren ein ACR20/50-Ansprechen und 70,1 und 49,5 % ein PASI 90/100-Ansprechen, unter der 150 mg-Dosierung waren es 79,4 und 52,6 % (ACR20/50) bzw. 59,2 und 44,2 % (PASI 90/100). (2)
Noch interessanter waren die ersten Ergebnisse der von Xenofon Baraliakos, Herne, präsentierten doppelblinden, placebokontrollierten Phase-IIIb-Studie MAXIMISE, in die für 52 Wochen 498 Patienten mit aktiver PsA (CASPAR-Kriterien) und klinisch diagnostizierter axialer Beteiligung (Wirbelsäulen-Schmerz VAS >40/100; im Mittel 73) und BASDAI ≥4 (im Mittel 7,3) trotz vorheriger Therapie mit ≥2 NSAR eingeschlossen wurden. Bei 30-70 % der PsA-Patienten kann auch das Achsenskelett betroffen sein, Klassifikationskriterien (ASAS und GRAPPA arbeiten derzeit daran) hierfür fehlen aber ebenso wie eindeutige Evidenz aus klinischen Studien. Aufgrund der guten Wirksamkeit von IL-17A-Inhibitoren sowohl bei PsA als auch ankylosierender Spondylitis (AS) lag für die Durchführung einer ersten solchen Studie in einem Kollektiv mit axialer PsA die Wahl von Secukinumab als Prüfsubstanz nahe.
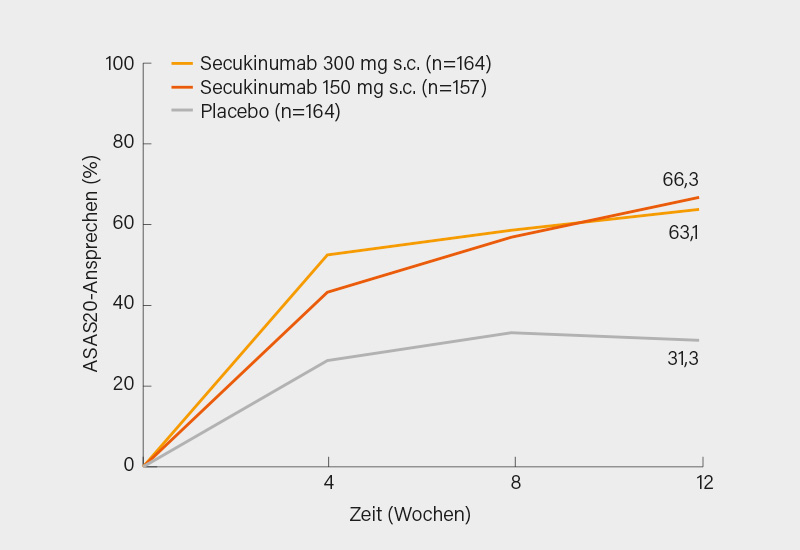
Die Patienten waren im Verhältnis 1:1:1 auf s.c. Secukinumab 300 mg oder 150 mg oder Placebo wöchentlich für 4 Wochen und dann alle 4 Wochen randomisiert worden. In Woche 12 wurden die Placebo-Patienten auf Secukinumab 300 oder 150 mg re-randomisiert. Der primäre Endpunkt war das ASAS20-Ansprechen auf Secukinumab 300 mg in Woche 12, als sekundärer Endpunkt war nach Nachweis der Überlegenheit von Secukinumab 300 mg im ASAS20-Ansprechen in Woche 12 festgelegt worden. Beide Endpunkte wurden signifikant erreicht: So betrug in Woche 12 das ASAS20-Ansprechen 63,1 % unter der 300 mg- und 66,3 % unter der 150 mg-Dosis (je p<0,0001) versus 31,3 % im Placebo-Arm (Abb. 2). Das Ergebnis war mit (65,1 und 67,3 vs. 33,9 %) und ohne Begleittherapie mit MTX (60,5 und 64,4 vs. 27,1 %) vergleichbar, ebenso das Sicherheitsprofil. Genaueres wird sich erst mit den vollumfänglichen Daten über 52 Woche sagen lassen, jedoch belegt die erste randomisierte, kontrollierte Studie zur axialen PsA überhaupt eine rasche, signifikante Verbesserung der Symptomatik durch den IL-17A-Inhibitor, wobei – ähnlich wie bei AS – womöglich die 150 mg-Dosierung ausreichen könnte. (3)
IL-23-Inhibitor Tildrakizumab überzeugt in Phase-II-Studie
Bereits am ersten Kongresstag hatte wiederum Philip J. Mease die Ergebnisse einer doppelblinden, randomisierten, placebokontrollierten Phase-II-Dosisfindungsstudie zu dem hochaffinen Anti-IL-23p19 monoklonalen Antikörper Tildrakizumab präsentiert, der nach 24 Wochen mit überzeugenden Daten aufwartete. Insgesamt 391 Patienten mit aktiver PsA (mittlere Krankheitsdauer knapp 7 Jahre, SJC 10, TJC 20, PASI ca. 7) wurden im Verhältnis 1:1:1:1:1 auf Tildrakizumab s.c. 200 mg alle 4 Wochen (Q4W), 200 mg alle 12 Wochen (Q12W), 100 mg Q12W, 20 mg Q12W bis Woche 24 oder Placebo Q4W bis Woche 24 randomisiert. Gestattet war zuvor max. eine Anti-TNF- (ca. 23 % der Fälle), nicht aber Anti-IL-17 oder -IL-12/23-Therapie, ebenso eine stabile Begleittherapie mit NSAR, Prednison und MTX oder Leflunomid. Primärer Endpunkt war das ACR20-Ansprechen in Woche 24, sekundäre Zielkriterien waren u. a. ACR50/70, PASI 75/90 und der SJC/TJC in Woche 24 sowie therapieassoziierte unerwünschte Ereignisse (TEAE).
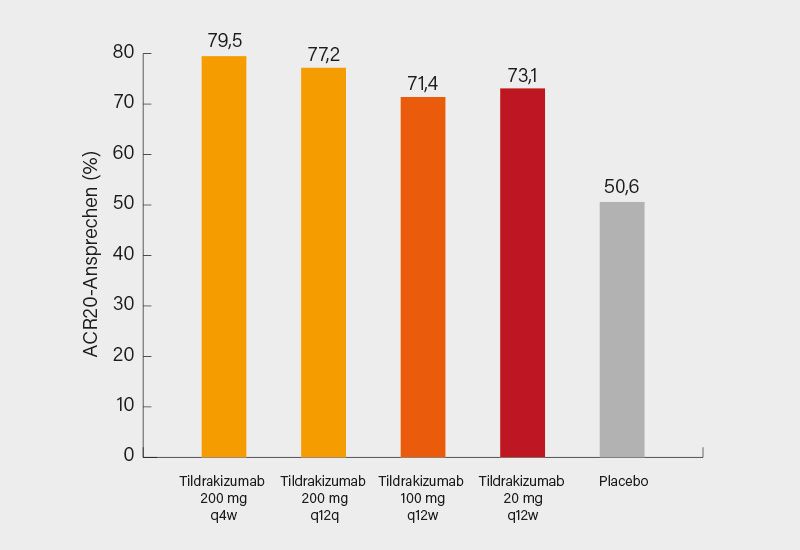
Im Ergebnis zeigte sich in Woche 24 ein signifikant besseres Ansprechen auf Tildrakizumab versus Placebo im ACR20/50/70- und PASI 75/90-Ansprechen, mit teils klaren Vorteilen bereits ab Woche 8. Am besten schnitt in puncto Gelenke meistens die 200 mg Q4W-Dosis (knapp gefolgt von 200 mg Q12Q) ab, mit einem ACR20-Ansprechen von 79,5 % (Abb. 3)sowie einem ACR50 bzw. 70 von 52,6 und 28,2 %. Beim PASI 75/90 war sogar die 200 mg Q12W-Dosis am effektivsten (79,6 bzw. 50,0 %). Auch Schmerzen und Enthesitis wurden signifikant gebessert, ohne dass es zu nennenswerten TEAE kam – die Verträglichkeit war gut. Angesichts des geringen Unterschieds in der Wirksamkeit scheint die 12-wöchentliche Gabe ausreichend zu sein, das Q4W-Regime brachte nur marginale zusätzliche Vorteile. (4) Von einer weiteren Evaluation des IL-23-Inhibitors in einer größeren Phase-III-Studie dürfte somit sicher auszugehen sein.
Was es sonst noch vom EULAR zu berichten gibt…
Insgesamt bleibt somit festzuhalten, dass die PsA weiter einen ausgesprochenen Boom im Hinblick auf die Verfügbarkeit neuer Therapien erlebt. So könnte noch vor Tildrakizumab – positive Phase-III-Daten vorausgesetzt, die IL-23-Hemmung in Form von Guselkumab das Therapiearsenal weiter bereichern, ebenso gespannt kann man auf die Phase-III-Studien zum dualen IL-17A/F-Inhibitor Bimekizumab und zum JAK-1-Inhibitor Filgotinib (die beide auch bei AS vielversprechende Kandidaten sind) sein. Apropos axiale Spondyloarthritis: hier gab es auf dem EULAR jenseits neuer Daten zur Bildgebung nur relativ wenig Neues zu berichten, zumal zwei positive Phase-III-Studien zu den beiden IL-17-Inhibitoren Brodalumab und Netakimab für Europa wohl letztlich keine Relevanz entfalten, da eine Zulassung für den ersteren nur in Asien und den letzteren nur in Russland angestrebt wird. Als nächste Schritte zu erwarten sind hierzulande die Zulassung von Ixekizumab bei zunächst AS und in der Folge dann wohl auch der nicht-radiografischen axialen SpA (positive Top-line-Ergebnisse aus COAST-X wurden bereits vorab gemeldet, genauere Daten dürften wohl auf dem ACR 2019 zu erwarten sein). Auch zu Secukinumab stehen in nächster Zeit Phase-III-Daten zur nicht-radiografischen axSpA in Aussicht.
Quellen:
- Ann Rheum Dis 2019; 78(Suppl2): 261 (LB0005)
- Ann Rheum Dis 2019; 78(Suppl2): 262 (LB0006)
- Ann Rheum Dis 2019; 78(Suppl2): 195-196 (OP0235)
- Ann Rheum Dis 2019; 78(Suppl2): 78-79 (LB0002)