Nachdem Rituximab bei Patienten mit proliferativer LN keinen eindeutigen Nutzen zeigen konnte, erfolgte nun ein neuer Anlauf mit dem stärker B-Zell-depletierenden Obinutuzumab, das analog zur LUNAR-Studie mit Rituximab gegen Placebo vor dem Hintergrund einer LN-Standardtherapie mit Mycopenolat Mofetil (MMF) und Glukokortikoiden (GK) getestet wurde. Insgesamt 125 erwachsene Patienten mit SLE (85 % Frauen, im Mittel 33 Jahre) gemäß den ACR-Kriterien, einer bioptisch gesicherten Klasse-III oder -IV aktiven oder aktiven/chronischen LN, Urin-Protein-Kreatinin-Ratio (UPCR) >1 im 24 h-Sammelurin und einer eGFR ≥30 mL/min/1,73 m2 wurden im Verhältnis 1:1 zusätzlich zu MMF (2-2,5 g/Tag) und GK nach festgelegtem Protokoll auf i.v. Obinutuzumab 1.000 mg oder Placebo an Tag 1 und in den Wochen 2, 24 und 26 randomisiert. Primärer Endpunkt war ein komplettes renales Ansprechen (CRR) in Woche 52, definiert als ein UPCR <0,5, normale Nierenfunktion ohne Verschlechterung des Serum-Kreatinin um >15 % und ein inaktives Urinsediment. Explorative Analysen wurden bis Woche 104 durchgeführt, auch angesichts der Tatsache, dass in LUNAR eine zu kurze Beobachtungsdauer als ein Grund für deren Scheitern angeführt wurde.
Besseres renales Ansprechen nach 2 Jahren
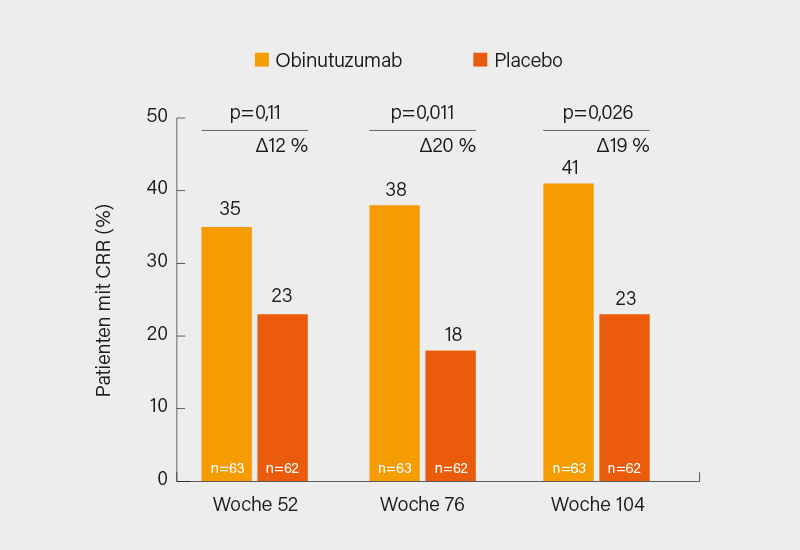
Der primäre Endpunkt eines CRR in Woche 52 wurde mit Obinutuzumab nicht erreicht (35 vs. 23 %, Δ12 %, 95% KI −3,4 bis 28 %; p=0,115), sehr wohl aber in Woche 76 (38 vs. 18 %, Δ20 %; p=0,011) und Woche 104 (41 vs. 23 %, Δ19 %; p=0,026) (Abb.). Im Hinblick auf die sekundären Endpunkte war gleichfalls das Ansprechen nach 104 Wochen deutlich stärker als in Woche 52 und dann fast durchweg signifikant. So zeigten sich nach zwei Jahren etwa signifikante Vorteile im renalen Gesamtansprechen (komplett oder partiell) mit 54 vs. 29 % (p=0,005), in der Veränderung von C3, C4 und Anti-dsDNA-Titer ab Baseline (je p<0,001) oder einem UPCR <0,5 (62 vs. 37 %; p=0,005). Zusammengefasst fielen die renalen und serologischen Parameter sowie eGFR und Proteinurie deutlich zugunsten der Therapie mit dem Typ-II Anti-CD20-Antikörper aus. Auffallend war die ausgeprägte B-Zell-Depletion, die zwischen Woche 0 und 52 von 93-98 % der Patienten erreicht wurde, in Woche 104 war eine solche noch bei 16 % (vs. 12 % unter der Standardtherapie) feststellbar. Damit fiel im indirekten Vergleich zu Rituximab (in der LUNAR-Studie) die B-Zell-Depletion deutlich stärker aus und scheint mit dem Ansprechen auf Obinutuzumab zu korrelieren. Am stärksten waren die Effekte bei starker Proteinurie zu Baseline und Klasse IV LN-Patienten.
Das Sicherheitsprofil von Obinutuzumab war durchaus positiv: Gegenüber Placebo kam es über 104 Wochen hinweg bei 91 vs. 89 % der Patienten zu ≥1 unerwünschten Ereignis (UE), bei 25 vs. 30 % zu ≥1 schweren UE und bei 8 vs. 18 % zu ≥1 schweren Infektion. Häufigste UE unter Obinutuzumab waren Harnwegsinfekte und Bronchitis. Es kam zu einem Todesfall unter Obinutuzumab gegenüber 4 im Placeboarm. Lediglich infusionsbezogene Reaktionen waren unter Obinutuzumab häufiger als unter Placebo. Angesichts des langfristig guten renalen Ansprechens gegenüber der Standardtherapie mit MMF und GK und einem relativ vorteilhaften Sicherheitsprofil ohne vermehrten schweren Ereignissen oder Infektionen darf man auf die künftigen Phase-III-Ergebnisse bereits sehr gespannt sein.
Quelle: Ann Rheum Dis 2021; doi: 10.1136/annrheumdis-2021-220920